
2024 ELCC|石远凯教授&邢镨元教授:基于GPS研究分析奥希替尼一线治疗后基因变异图谱,展望后线精准治疗新趋势
前言
2024年欧洲肺癌大会(ELCC)于中欧时间3月20日-23日在捷克布拉格召开。作为肺癌领域备受关注的重要国际学术会议之一,ELCC汇聚了全球肺癌诊疗的最新技术及研究成果。本次ELCC大会公布了GPS研究——奥希替尼 一线治疗失败后基因变异图谱的中期分析结果,最终结果有待全组数据公布。医脉通特邀该研究主要研究者——中国医学科学院肿瘤医院石远凯教授及邢镨元教授对GPS研究中奥希替尼一线治疗后基因变异图谱及其对治疗策略的影响进行点评。
一线治疗失败后基因变异图谱的中期分析结果,最终结果有待全组数据公布。医脉通特邀该研究主要研究者——中国医学科学院肿瘤医院石远凯教授及邢镨元教授对GPS研究中奥希替尼一线治疗后基因变异图谱及其对治疗策略的影响进行点评。
GPS研究:解析奥希替尼一线治疗失败后基因变异图谱,探寻后线治疗方向
第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)奥希替尼是目前EGFR突变晚期非小细胞肺癌(NSCLC)患者一线治疗首选方案,但仍会在治疗后19个月左右发生疾病进展。GPS研究前瞻性纳入奥希替尼一线治疗失败后的EGFR突变局部晚期或转移性NSCLC患者,旨在探索其耐药机制。该研究使用下一代测序技术(NGS)等方法分析疾病进展时患者配对的组织和血浆样本的基因变异特征,并以组织样本作为对照,分析血浆样本中EGFR扩增、MET 扩增、EGFR C797S突变及其它EGFR非敏感突变的一致性(图1)[1,2]。
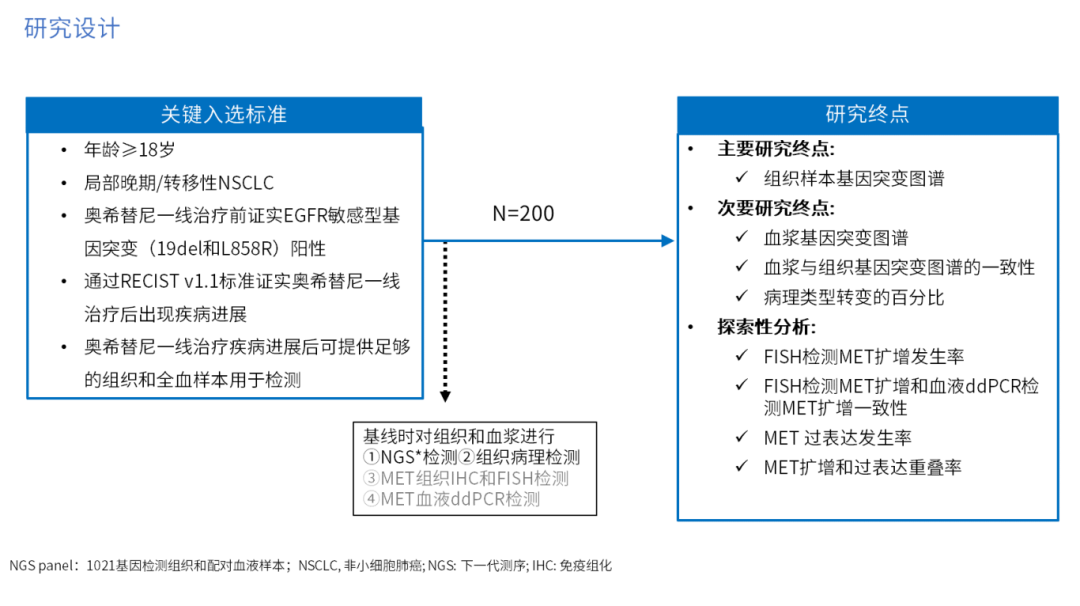
图1. GPS研究设计
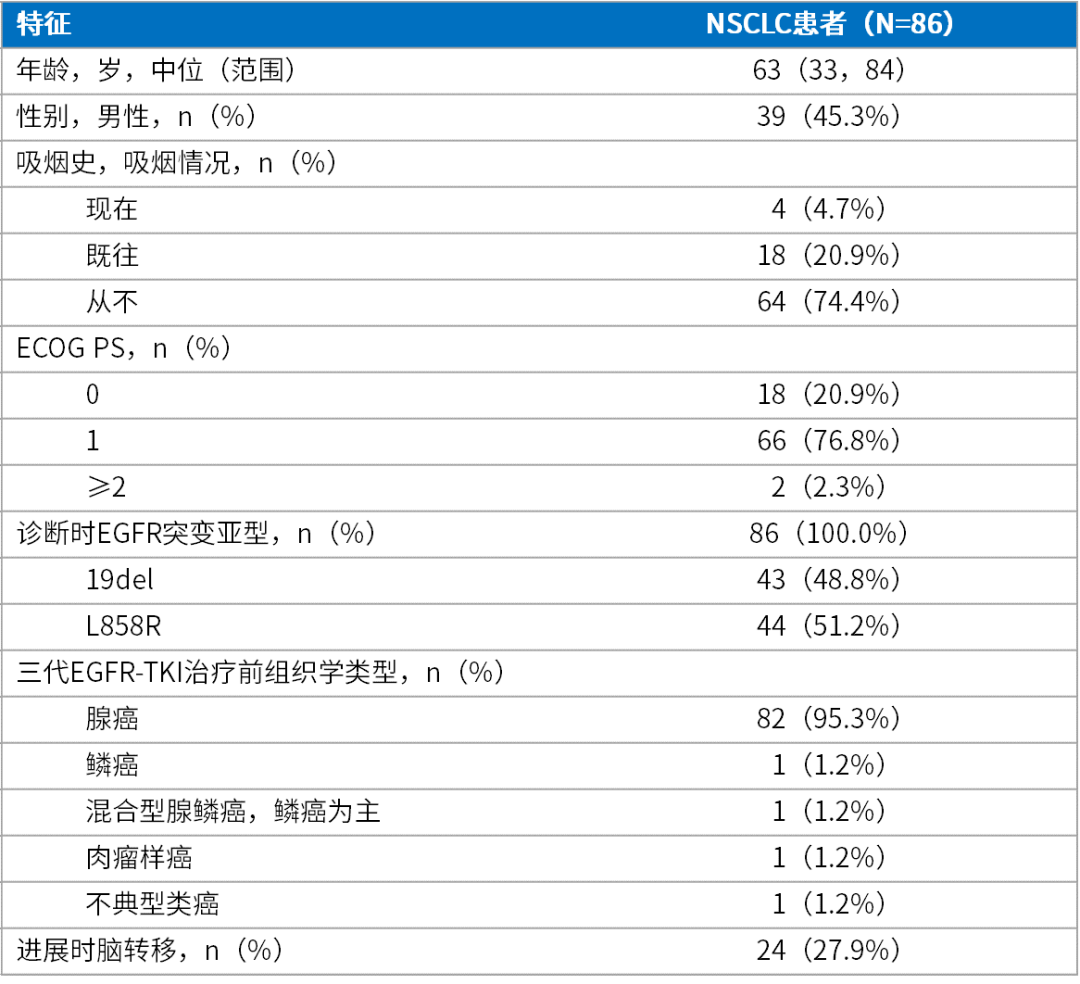
自2022年2月至2023年10月,GPS研究共纳入86例患者进行配对的组织和血浆样本分析。基线特征显示,患者中位年龄为63岁(范围33-84岁),45.3%为男性,美国东部肿瘤协作组(ECOG)体能状态评分(PS)大多为0-1(97.7%)(表1)[1]。
表1. 入组患者基线特征
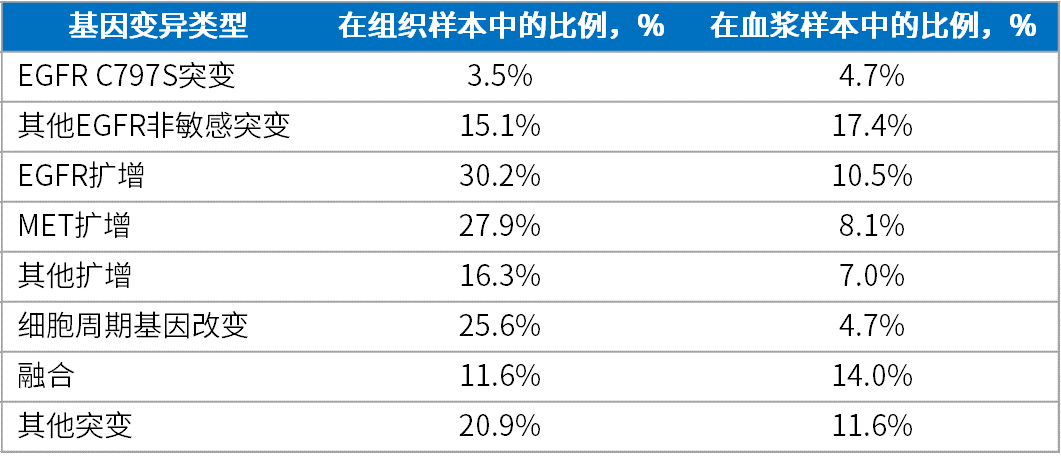
在奥希替尼一线治疗进展阶段,组织样本中检测到的基因变异为EGFR C797S突变(3.5%)、其他EGFR非敏感突变(15.1%)、EGFR扩增(30.2%)、MET扩增(27.9%)、其他扩增(16.3%)、细胞周期基因改变(25.6%)、融合(11.6%)和其他突变(20.9%)。还发现2例(2.3%)患者发生组织学转化,1例转化为小细胞肺癌(SCLC),另1例转化为鳞癌[1]。EGFR扩增及MET扩增是其中最为常见的耐药后基因变异(表2)。
在配对血浆样本中检测到的基因变异图谱与组织样本相似,但各耐药基因占比不同,包括EGFR C797S突变(4.7%)、其他EGFR非敏感突变(17.4%)、EGFR扩增(10.5%)、MET扩增(8.1%)、其他扩增(7.0%)、细胞周期基因改变(4.7%)、融合(14.0%)和其他突变(11.6%)(表2)[1]。
表2. 组织样本及血浆样本基因变异图谱
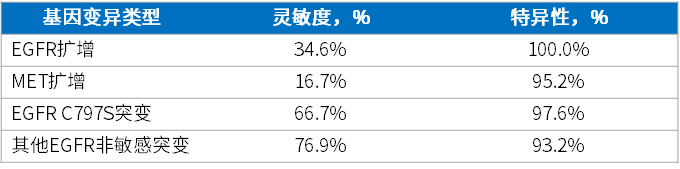
以组织样本为对照,配对血浆样本中EGFR扩增、MET扩增、EGFR C797S突变和其他EGFR非敏感突变的灵敏度分别为34.6%、16.7%、66.7%和76.9%,特异性分别为100.0%、95.2%、97.6%和93.2%[1](表3)。相对于组织检测,使用血浆样本的液体活检对奥希替尼一线治疗失败后的常见获得性耐药基因具有高度特异性,但灵敏度较低。
表3. 特定基因灵敏度和特异性分析
总体来看,奥希替尼一线治疗失败后的EGFR突变局部晚期或转移性NSCLC患者的基因变异图谱较为复杂,最常见的是EGFR 扩增和MET 扩增,其他常见变异包括EGFR C797S突变、其他EGFR非敏感突变及融合等。当组织样本难以获取时,血浆可作为耐药基因检测的替代样本[1]。
专家点评
石远凯教授(中国医学科学院肿瘤医院):奥希替尼作为全球首个第三代EGFR-TKI,已在FLAURA研究中展现出比第一代EGFR-TKI优异的疗效和良好的安全性,是目前唯一*用于EGFR敏感突变晚期NSCLC具有显著总生存期(OS)获益的EGFR-TKI[3],已被国内外指南推荐为一线优选药物[4,5]。然而,与所有靶向药物一样,奥希替尼也逃脱不了耐药难题,克服奥希替尼的耐药是当前EGFR突变NSCLC患者高度未被满足的治疗需求[5]。当前各大指南对于奥希替尼耐药后的推荐治疗方案仍以化疗为主[3,4],但明确奥希替尼的耐药机制,可以根据基因变异情况,在后线治疗中为患者提供变异基因的精准治疗方案,使患者可以继续从靶向治疗中获益。
以奥希替尼为代表的三代EGFR-TKI耐药机制分为原发性耐药和获得性耐药。获得性耐药主要包括EGFR依赖性、EGFR非依赖性、组织学转化以及未知耐药机制。其中,EGFR C797S突变是最主要的EGFR依赖性耐药机制,其他包括L982X、G796X、L718Q突变及EGFR扩增等;MET扩增是最主要的EGFR非依赖性耐药机制,其他耐药机制还包括平行旁路激活、下游信号通路激活及细胞周期相关基因变异等。基于不同耐药机制探索个体化靶向治疗方案,不仅可以进一步延长患者生存,还可以保证患者在治疗过程中的生活质量[6]。
GPS研究在中国患者中进行,进一步明确了中国EGFR突变NSCLC患者在奥希替尼一线治疗失败后的基因变异图谱,为阐明中国患者的耐药基因变异图谱提供了新证。研究结果显示EGFR 扩增和MET 扩增是最常见的获得性耐药机制,其他常见耐药机制还包括EGFR非敏感突变和基因融合等[1]。GPS研究为奥希替尼一线治疗失败后中国EGFR突变NSCLC患者后续靶向治疗及个体化治疗方案提供了重要依据。
目前,针对奥希替尼一线治疗失败后获得性耐药机制的探索越来越多,可供选择的耐药后治疗方案也在不断地探索过程中。已有多项临床研究探索奥希替尼不同获得性耐药机制的后续治疗方案,包括奥希替尼联合针对耐药靶点(MET等)的药物、奥希替尼联合抗血管生成药物、MET/EGFR双特异性抗体或抗体偶联药物等,助力患者更多的获益[6]。根据患者不同耐药机制及进展情况,对患者进行靶向治疗与个体化治疗,助力EGFR突变NSCLC走向长生存之路,是未来的研究方向。
邢镨元教授(中国医学科学院肿瘤医院):EGFR基因的发现推动了以生物标志物为指导的晚期NSCLC患者的精准治疗模式,第三代EGFR-TKI奥希替尼一线治疗已经在FLAURA研究中证实了与第一代EGFR-TKI相比具有显著OS获益[3,6]。随着奥希替尼的广泛应用,其获得性耐药问题也受到越来越多的临床关注,耐药机制的探索和检测愈发重要。
EGFR-TKI主要通过与EGFR酪氨酸激酶区域的三磷酸 腺苷
腺苷 竞争性结合,从而阻断EGFR信号通路的传递,当患者经EGFR-TKI治疗前后发生EGFR基因其他位点的二次突变或EGFR旁路激活等情况时,均可导致对EGFR-TKI产生耐药[5]。对于奥希替尼治疗耐药后进展的患者,NGS等广谱分子检测有助于更全面地找出患者耐药机制,进而为后续治疗提供有指导价值的信息[7]。组织检测是肿瘤基因检测的“金标准”,多个指南和共识均推荐首选组织样本进行检测[4-7]。组织活检不仅能够进行基因检测鉴别耐药后基因变异,还可以明确肿瘤是否发生组织学转化[7]。
竞争性结合,从而阻断EGFR信号通路的传递,当患者经EGFR-TKI治疗前后发生EGFR基因其他位点的二次突变或EGFR旁路激活等情况时,均可导致对EGFR-TKI产生耐药[5]。对于奥希替尼治疗耐药后进展的患者,NGS等广谱分子检测有助于更全面地找出患者耐药机制,进而为后续治疗提供有指导价值的信息[7]。组织检测是肿瘤基因检测的“金标准”,多个指南和共识均推荐首选组织样本进行检测[4-7]。组织活检不仅能够进行基因检测鉴别耐药后基因变异,还可以明确肿瘤是否发生组织学转化[7]。
既往已有多项研究对奥希替尼一线治疗失败后的获得性耐药机制进行了探索,MET扩增(17%)和EGFR C797S突变(15%)是奥希替尼一线治疗失败后最常见的获得性耐药机制[8]。值得注意的是,研究中奥希替尼一线进展后的患者中仅有39%具有有效NGS结果的配对组织样本,提示晚期NSCLC疾病进展时获取组织样本具有挑战性,探索合适的替代样本十分重要[8]。
此次ELCC大会公布的GPS研究不仅对EGFR突变NSCLC患者接受奥希替尼一线治疗失败后的基因变异图谱进行了分析,还对NGS检测的血浆样本和组织样本结果进行了对比,配对的血浆样本中检测到的基因变异图谱与组织样本相似,且对于奥希替尼一线治疗常见获得性耐药基因,血浆样本较组织样本具有高度特异性,虽然灵敏度较低,但若难以获取组织样本,血浆可考虑作为奥希替尼一线治疗失败后基因检测的替代样本[1]。
GPS研究为一线奥希替尼治疗失败后中国EGFR突变NSCLC患者的基因检测手段和后线治疗方案的制定提供了依据。期待未来随着基因检测技术的广泛应用和标准治疗方案的精准施治,NSCLC的治疗版图会更加清晰,使更多患者有机会接受精准化、个体化的治疗方案,达到更长生存。
专家简介


备注:*截至发稿日

