
智读指南 | 大咖视角!黄镜教授重磅解读新版NCCN食管癌诊疗指南更新要点
2024年3月,NCCN正式发布了《食管和食管胃结合部癌诊疗指南(2024.V1版)》,与2023.V4版指南¹相比,新版指南进行了多项修订。近日,NCCN更新发布了《食管和食管胃结合部癌诊疗指南(2024.V2版)》²,将我国原研PD-1抑制剂——替雷利珠单抗 正式纳入到晚期食管和食管胃结合部鳞癌的二线治疗推荐中。医脉通特邀中国医学科学院肿瘤医院黄镜教授,对2024.V1和2024.V2版指南更新要点抽丝剥茧,进行精彩解读。
正式纳入到晚期食管和食管胃结合部鳞癌的二线治疗推荐中。医脉通特邀中国医学科学院肿瘤医院黄镜教授,对2024.V1和2024.V2版指南更新要点抽丝剥茧,进行精彩解读。

诊断检查
诊断检查第13条中的“可以考虑第二代测序(NGS)”更新为“应该考虑第二代测序(NGS)”。
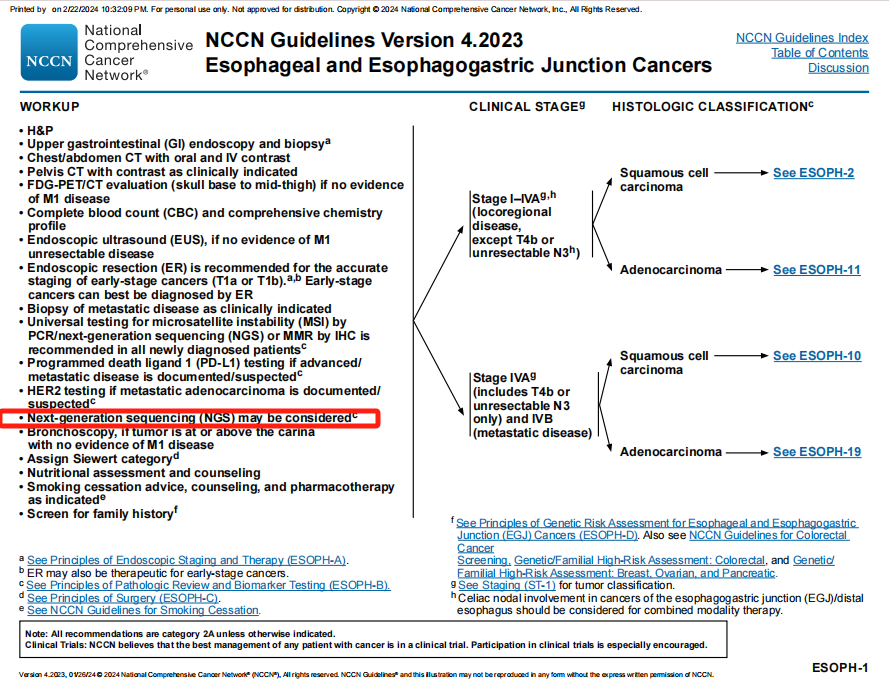

旧版指南(上)与新版指南(下)
ESOPH-1
临床上适合手术的患者的初始治疗选择
“消融后内镜下切除术(ER)”修订为“ER±消融”,并删除了旧版中单独成项的ER。


旧版指南(上)与新版指南(下)
ESOPH-3、ESOPH-8、ESOPH-12、ESOPH-17
新增脚注z:对于特定患者,考虑通过系统治疗来缓解吞咽困难 。参考全身治疗原则(ESOPH-F)和姑息治疗/最佳支持治疗原则(ESOPH-H)。
。参考全身治疗原则(ESOPH-F)和姑息治疗/最佳支持治疗原则(ESOPH-H)。

ESOPH-4、ESOPH-5、ESOPH-13、ESOPH-14A
在术前放化疗和根治性放化疗的缓解评估路径中,将“FDG-PET/CT(首选)或FDG-PET”修订为“FDG-PET/CT”。
在附加管理中,将“监测”修订为“观察”。


旧版指南(上)与新版指南(下)
ESOPH-5、ESOPH-14
鳞癌患者的术后治疗选择
对于未接受术前放化疗患者的术后管理,在R0切除术路径中,将“监测”修订为“观察”。
ESOPH-6、ESOPH-7、ESOPH-15
对于接受术前放化疗患者的术后管理,在R1切除和R2切除路径中,将“观察直至进展”修订为“观察”。
ESOPH-7、ESOPH-16
鳞癌患者的监测随访与姑息治疗
局部复发路径中,将“化疗”修订为“全身治疗”。
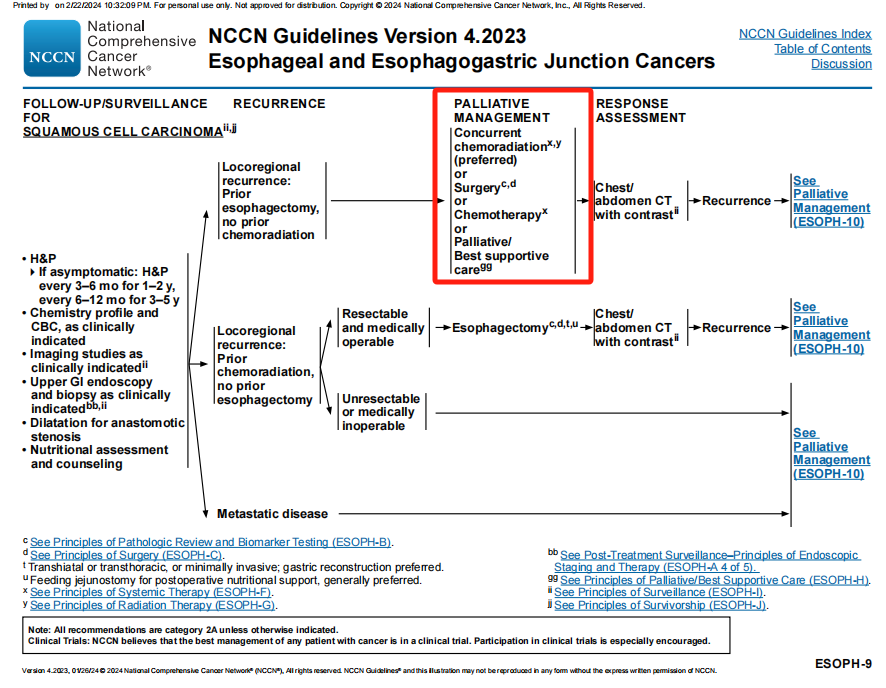

旧版指南(上)与新版指南(下)
ESOPH-9
在KPS体能评分≥60%或ECOG体能评分≤2路径中,将“可以应用第二代测序(NGS)进行检测分析”修订为“应该应用第二代测序(NGS)进行检测分析”。


旧版指南(上)与新版指南(下)
ESOPH-10
内镜分期和治疗
在内镜分期治疗原则中,总体新增早期食管鳞状细胞癌的内镜治疗(ESOPH-A 2/7)和早期重度异型增生(HGD)/食管腺癌的内镜治疗(ESOPH-A 3/7)两个章节。
ESOPH-A
引言精简修订为“内窥镜检查已成为诊断、分期、治疗和监测食管癌 和食管胃交界部癌
和食管胃交界部癌 (EGJ癌)的重要工具。”
(EGJ癌)的重要工具。”
诊断部分第3条,新增“应该考虑使用帽来改善胃食管连接部癌(EGJ癌)的可视化情况”。
诊断部分第5条修订为“ER成功后,可能需要切除和/或消融剩余的Barrett肿瘤。此外,需要进行密切的内镜监测”。
删除诊断部分第6条。


旧版指南(上)与新版指南(下)
ESOPH-A 1/7
病理检查 和生物标志物检测
和生物标志物检测
对于第二代测序(NGS),新版指南修订为“目前,几种靶向治疗药物(ESOPH-F)已经被FDA批准用于治疗食管癌和食管胃交界部癌(EGJ癌)。应首先考虑进行免疫组化/原位杂交/靶向PCR来鉴定生物标志物,然后进行NGS检测。如果可用的组织有限,或患者无法进行传统的活检,对单一生物标志物/有限的分子诊断面板的连续检测将耗尽样本。在这些情况下,或由主治医生自行决定,应该在CLIA批准的实验室应用第二代测序(NGS)进行全面的基因组分析。”
新增靶向生物标志物列表,具体包括:
HER2过表达/扩增
免疫组化法检测PD-L1表达
微卫星不稳定性
肿瘤突变负荷
NTRK基因融合
RET基因融合
BRAF V600E突变
删除脚注“FDA批准的生物仿制药是曲妥珠单抗 的合适替代品”和“参考见NCCN免疫治疗相关毒性管理指南”。
的合适替代品”和“参考见NCCN免疫治疗相关毒性管理指南”。


旧版指南(上)与新版指南(下)
ESOPH-B 5/6
更新解读
黄镜教授:靶向及免疫治疗在食管癌中的应用显著改善了相应患者群的生存获益,恰当且精准的生物标志物检测是靶向和免疫治疗的应用基础。NCCN指南本次更新,对靶向生物标志物进行了明确的推荐,具体包括①HER2过表达/扩增、②免疫组化法检测PD-L1表达、③微卫星不稳定性、④肿瘤突变负荷、⑤NTRK基因融合、⑥RET基因融合、⑦BRAF V600E突变。
这其中,HER2和PD-L1表达水平作为食管癌的重要标志物,已经成为了公认的分层依据。对于HER2阳性PD-L1混合阳性评分(CPS)≥1的食管腺癌患者,KEYNOTE-811³,⁴等研究的重磅数据为曲妥珠单抗+帕博利珠单抗 +化疗的临床应用提供了坚实的循证医学基础。另外,目前食管癌的最佳免疫治疗生物标志物仍未有定论,微卫星状态(MSI)与肿瘤突变负荷(TMB)都是PD-L1表达水平强有力的竞争者。因此,无论是腺癌或鳞癌,一线或二线/后线,指南均根据这两个指标给出了独立于PD-L1表达水平的免疫治疗用药推荐,如下图所示。
+化疗的临床应用提供了坚实的循证医学基础。另外,目前食管癌的最佳免疫治疗生物标志物仍未有定论,微卫星状态(MSI)与肿瘤突变负荷(TMB)都是PD-L1表达水平强有力的竞争者。因此,无论是腺癌或鳞癌,一线或二线/后线,指南均根据这两个指标给出了独立于PD-L1表达水平的免疫治疗用药推荐,如下图所示。
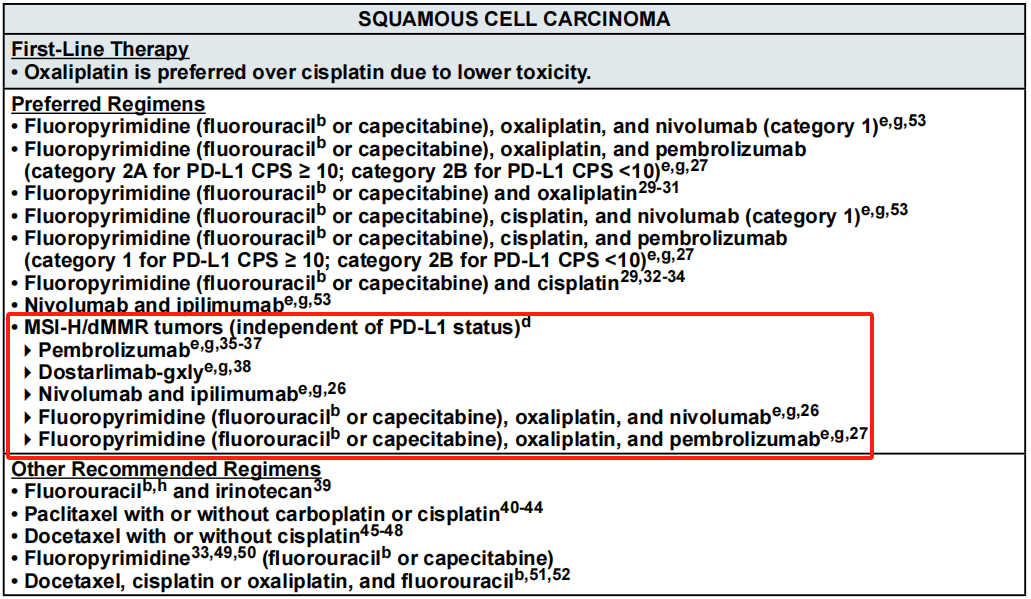
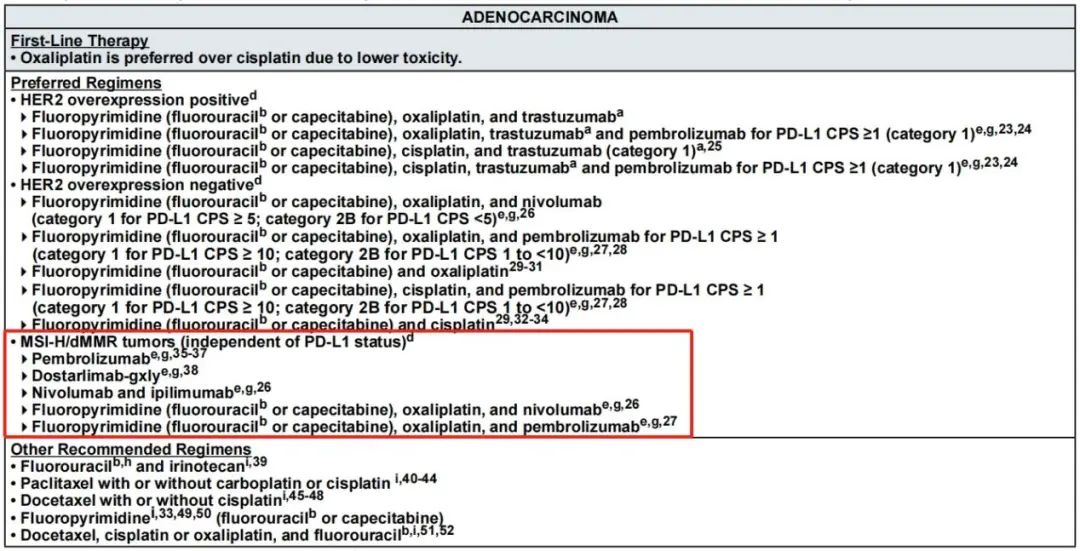


指南根据MSI和TMB状态进行的治疗推荐
同时,随着对食管癌分子机制的进一步探索,NTRK、RET和BRAF V600E等基因也逐渐成为了用药靶点。例如,根据Doebele RC⁵和Drilon A⁶等人的研究,指南建议将恩曲替尼 或拉罗替尼应用于NTRK基因融合食管癌患者的二线/后线治疗;根据NCI-MATCH研究亚组H⁷的结果,指南建议将达拉非尼
或拉罗替尼应用于NTRK基因融合食管癌患者的二线/后线治疗;根据NCI-MATCH研究亚组H⁷的结果,指南建议将达拉非尼 +曲美替尼
+曲美替尼 联合应用于BRAF V600突变型食管癌患者的二线/后线治疗;根据LIBRETTO-001研究⁸的结果,指南建议将塞普替尼
联合应用于BRAF V600突变型食管癌患者的二线/后线治疗;根据LIBRETTO-001研究⁸的结果,指南建议将塞普替尼 应用于RET基因融合型食管癌患者的二线/后线治疗。
应用于RET基因融合型食管癌患者的二线/后线治疗。
尽管目前上述方案并未在我国完全获批,但其后续探索值得进一步关注,同时,NCCN指南对生物标志物检测的推荐力度也值得我们正视与思考。
全身治疗
对于不可切除的局部晚期、复发或转移性HER2阴性腺癌,一线首选治疗方案增加“PD-L1 CPS≥1”的补充。
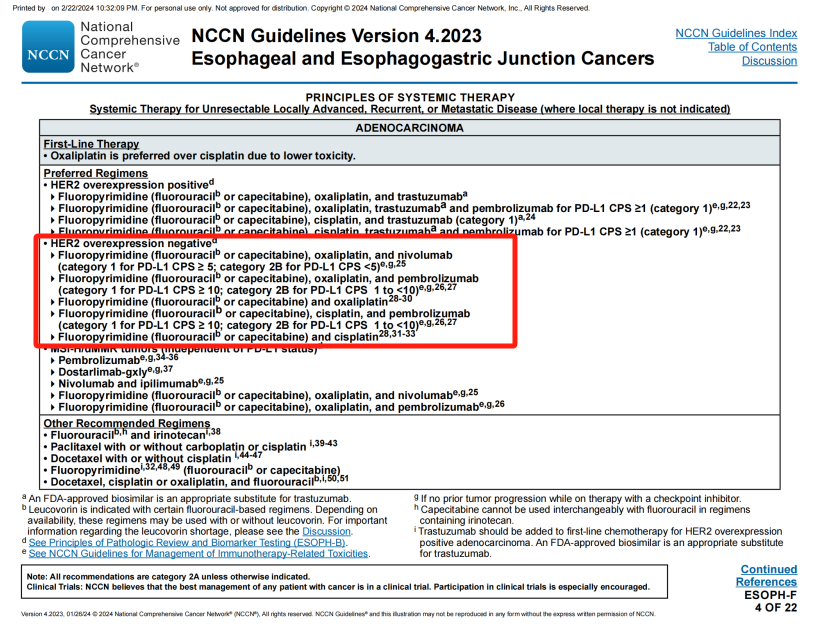
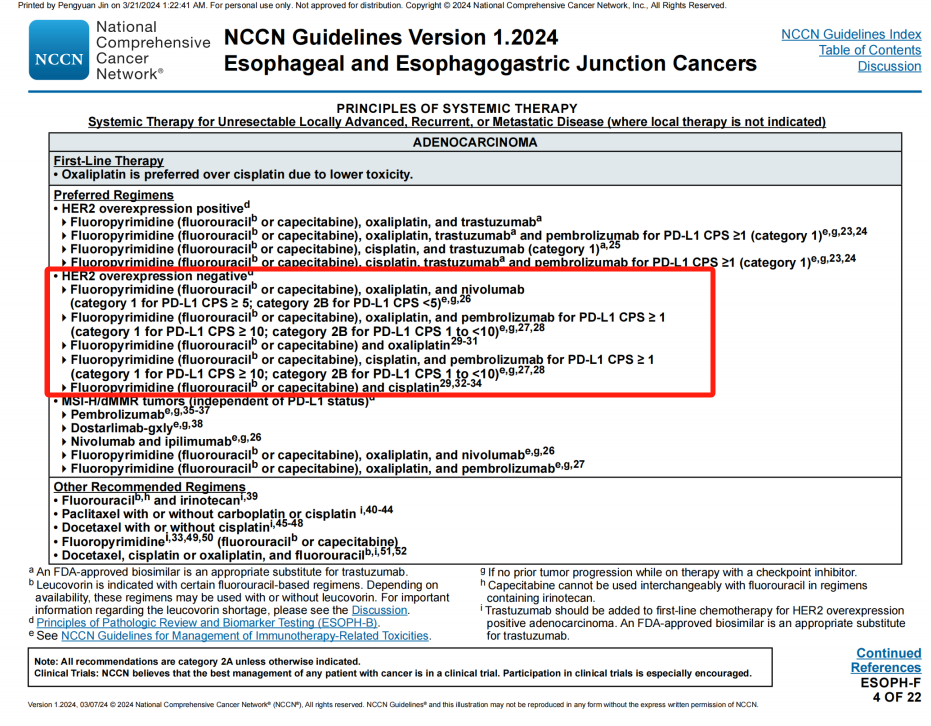
旧版指南(上)与新版指南(下)
ESOPH-F 4/22
对于鳞状细胞癌,一线首选治疗方案中,“氟嘧啶(氟尿嘧啶 或卡培他滨
或卡培他滨 )、奥沙利铂
)、奥沙利铂 联合纳武利尤单抗
联合纳武利尤单抗 ”方案和氟嘧啶(氟尿嘧啶或卡培他滨)、顺铂
”方案和氟嘧啶(氟尿嘧啶或卡培他滨)、顺铂 联合纳武利尤单抗”方案由“2A类推荐”改为“1类推荐”。
联合纳武利尤单抗”方案由“2A类推荐”改为“1类推荐”。


旧版指南(上)与新版指南(下)
ESOPH-F 5/22
不可切除局部进展或转移性食管鳞癌的二线治疗首选方案中,新增“替雷利珠单抗(1类证据)”,并在ESOPH-F 17/22中增加了该方案的用药剂量,为“200 mg IV,D1,每21天为1个循环”。


旧版指南(上)与新版指南(下)
ESOPH-F 7/22
更新解读
黄镜教授:2024年3月15日,FDA正式批准替雷利珠单抗应用于不可切除或转移性食管鳞癌的二线或后线治疗,在4月23日发布的V2版指南中,指南编写组将该方案纳入到食管鳞癌的二线治疗推荐中。
该推荐主要基于RATIONALE-302研究,这是一项全球、随机、开放标签III期临床研究,共纳入了521例一线系统治疗期间或之后疾病进展的局部晚期不可切除/转移性食管鳞癌患者。患者随机(1:1)分配接受替雷利珠单抗单药或研究者选择的化疗治疗。研究的主要终点为意向性治疗(ITT)人群的总生存期(OS),次要终点包括PD-L1肿瘤区域阳性评分(TAP)≥10%患者的OS、无进展生存期(PFS)、客观缓解率(ORR)和缓解持续时间(DOR)等。
结果显示,研究达到了主要终点,替雷利珠单抗组和化疗组的中位OS分别为8.6个月和6.3个月(HR=0.70,95%CI:0.57-0.85,p=0.0001)。对于CPS≥10%的患者群,两组的中位OS分别为10.3个月和6.3个月(HR=0.54,95%CI:0.57-0.85,p=0.0001),如下图A、B所示。
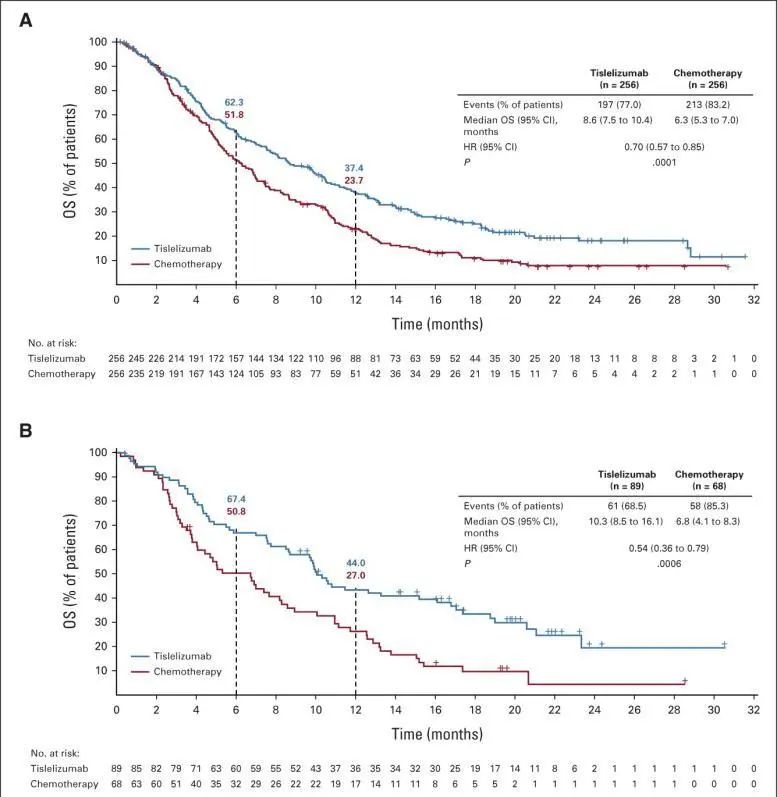
安全性方面,替雷利珠单抗的安全性特征与既往研究一致,并且优于化疗。替雷利珠单抗最常见的治疗相关不良事件包括天冬氨酸转氨酶升高(11.4%)、贫血 (11.0%)和甲状腺功能减退(10.2%)。
(11.0%)和甲状腺功能减退(10.2%)。
该研究成果于2022年发表于Journal of Clinical Oncology⁹,北京大学肿瘤医院沈琳教授为第一作者。
在这之后的2024年1月份,ESMO Open发表了针对RATIONALE-302研究欧洲/北美人群进行的亚组分析¹⁰,分析共纳入108例患者(55 VS. 53)。结果显示,替雷利珠单抗组和化疗组的中位OS分别为11.2个月和6.3个月(HR=0.55,95%CI:0.35-0.87,p=0.0001),如下图所示。
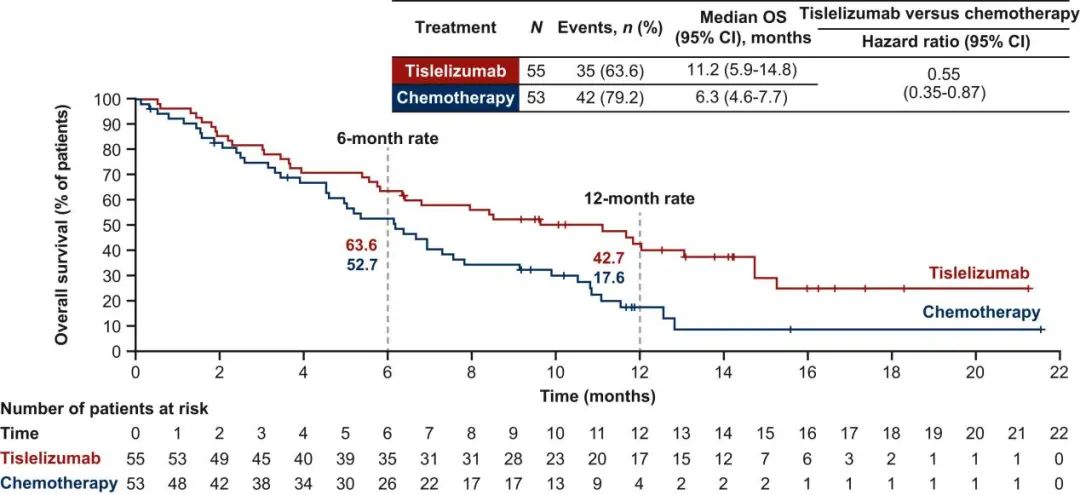
安全性分析提示,替雷利珠单抗组与化疗组≥3级治疗相关不良事件的发生率分别为13.0%和51.0%,安全性良好。
基于上述两项分析,NCCN指南正式将替雷利珠单抗纳入二线及后线治疗推荐中,这是国产PD-1抑制剂首次登上NCCN食管及食管胃结合部诊疗指南,可谓意义深远。
对于MSI-H/dMMR肿瘤患者的新辅助或围手术期免疫治疗,方案“每3周静脉给药帕博利珠单抗200mg,持续8周,随后进行手术”修订为“每3周静脉给药帕博利珠单抗200mg,至少持续12周,随后进行手术”。
ESOPH-F 9/22
姑息治疗/最佳支持治疗
对于存在吞咽困难的患者,新版指南将“相比之下,由于担心支架相关不良事件可能会妨碍根治性手术,对于可能接受根治性手术的患者,通常不建议放置支架治疗。”补充修订为“相比之下,由于担心支架相关不良事件可能会妨碍根治性手术或增加放化疗期间的急性毒性,对于可能接受根治性手术或处于放化疗期间的患者,通常不建议放置支架治疗。”
ESOPH-H 1/3
随访
对于接受三联疗法的II或III期(T2-T4,N0-N+,T4b)患者,将“由于文献表明局部/区域复发是不常见的,临床上不建议进行EGD监测。”修订为“由于文献表明局部/区域复发是不常见的,需要根据临床指征进行EGD监测。”
ESOPH-I 1/3
对于接受化疗新辅助治疗或放化疗序贯食管切除术(±辅助治疗)的患者,监测建议新增“根据临床指征进行EGD监测”。
在影像学检查建议中,将“除了有禁忌证的患者,都建议进行胸部/腹部CT 检查”修订为“除了有禁忌证的患者,都建议进行口服、静脉造影胸部/腹部CT检查”。
检查”修订为“除了有禁忌证的患者,都建议进行口服、静脉造影胸部/腹部CT检查”。
ESOPH-I 2/3

