
2024 ASCO︱ZUMA-3研究再添新证,R/R B-ALL患者接受Brexu-cel后获益可持续4年以上
成人急性淋巴细胞白血病 (ALL)是成人最常见的急性白血病之一,约占成人急性白血病的20%-30%[1]。成人B-ALL患者复发率高,总体预后较差;与此同时,经历过1次挽救性治疗的患者1年总生存率仅为26%,且随着复发次数升高生存期逐渐下降[2]。在今年5月31日~6月4日召开的美国临床肿瘤学会(ASCO)年会[3]中,大会以口头报告(Oral)的形式公布了Brexucabtagene autoleucel(Brexu-cel)在R/R B-ALL患者中的长期随访数据,为Brexu-cel的临床应用提供更多证据[4,5]。本期特邀北京大学人民医院江浩教授与吕萌副教授就ZUMA-3研究长期随访结果发表真知灼见。
(ALL)是成人最常见的急性白血病之一,约占成人急性白血病的20%-30%[1]。成人B-ALL患者复发率高,总体预后较差;与此同时,经历过1次挽救性治疗的患者1年总生存率仅为26%,且随着复发次数升高生存期逐渐下降[2]。在今年5月31日~6月4日召开的美国临床肿瘤学会(ASCO)年会[3]中,大会以口头报告(Oral)的形式公布了Brexucabtagene autoleucel(Brexu-cel)在R/R B-ALL患者中的长期随访数据,为Brexu-cel的临床应用提供更多证据[4,5]。本期特邀北京大学人民医院江浩教授与吕萌副教授就ZUMA-3研究长期随访结果发表真知灼见。
ZUMA-3研究:R/R B-ALL患者接受Brexu-cel治疗后的长期生存结局
01研究设计
本研究纳入≥18岁、美国东部肿瘤协作组(ECOG)评分为0-1分、骨髓中原始或幼稚淋巴细胞>5%的R/R B-ALL成人患者,复发或难治性定义为:1)原发难治性,或2)一线治疗后首次缓解时间≤12个月的首次复发,或3)经≥2线治疗后复发或难治,或4)异基因造血干细胞移植治疗(allo-SCT)后复发或难治[1]。
患者接受单采与清淋处理后,给予回输Brexu-cel(1×106 CAR-T细胞/kg)。
主要终点为独立评审委员会评估的CR/CRi,关键次要终点为OS。此外,描述性分析报告了探索性亚组分析结果。
02入组人群
截止至2023年7月23日,78例接受Brexu-cel(1×106 CAR-T细胞/kg)治疗的R/R B-ALL患者随访长达4年以上,中位随访时间为53.6个月(范围,44.7个月-82.3个月)。
03疗效结果
评估所有患者人群中的Brexu-cel的生存获益(图1)。在所有78例接受1×106 CAR-T细胞/kg剂量回输的患者人群中,中位OS为25.6个月(95% CI,16.2个月-60.4个月)。
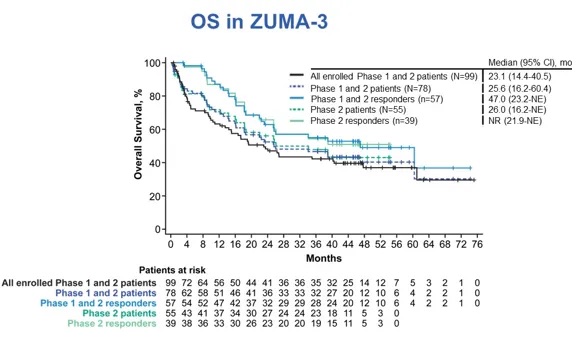
图1 所有患者人群的OS,采用Kaplan-Meier分析评估
在57例达到CR/CRi的患者中,中位OS为47.0个月(95% CI,23.2个月-NE)。根据后续是否接受allo-SCT情况,分析Brexu-cel治疗获益(图2)。CAR-T细胞疗法后接受allo-SCT的患者(n=14)的中位OS低于未接受allo-SCT的患者(n=43),两者中位OS分别为36.3个月(95% CI,10.2个月-NE)与60.4个月(95% CI,23.2个月-NE)。
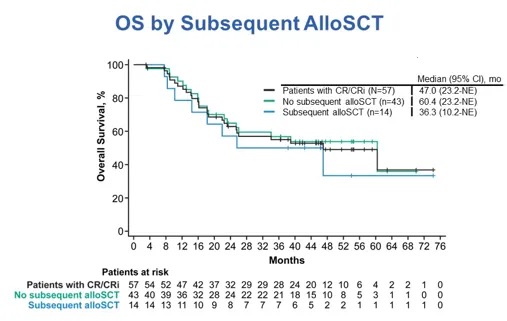
图2 基于allo-SCT情况的OS亚组分析,采用Kaplan-Meier分析评估
基于患者年龄与既往治疗线数,分析Brexu-cel治疗获益(图3)。在既往接受过1线治疗的患者(n=15)与≥2线治疗的患者(n=63)中,中位OS分别为60.4个月(95% CI,7.6个月-NE)与25.4个月(95% CI,15.9个月-47.0个月);在年龄<26岁的患者(n=15)与≥26岁的患者(n=63)中,中位OS分别为23.2个月(95% CI,9.0个月-NE)与26.0个月(95% CI,15.9个月-NE)。
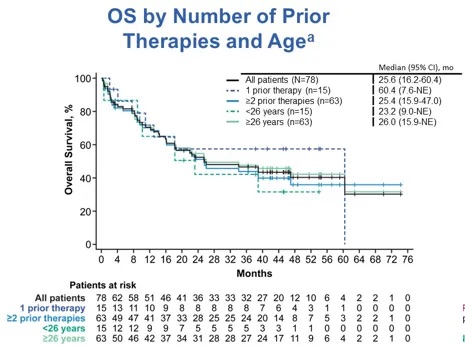
图3 基于年龄与既往治疗线数的OS亚组分析,采用Kaplan-Meier分析评估
基于既往接受贝林妥欧单抗 (Blinatumomab)与奥加伊妥珠单抗
(Blinatumomab)与奥加伊妥珠单抗 (Inotuzumab)的治疗情况,分析Brexu-cel治疗获益(图4)。在既往接受过贝林妥欧单抗的患者(n=38)与既往未接受过的患者(n=40)中,中位OS分别为15.9个月(95% CI,8.3个月-26.0个月)与60.4个月(95% CI,18.6个月-NE);在既往接受过奥加伊妥珠单抗的患者(n=17)与既往未接受过的患者(n=61)中,中位OS分别为8.8个月(95% CI,2.2个月-34.1个月)与38.9个月(95% CI,18.6个月-NE)。
(Inotuzumab)的治疗情况,分析Brexu-cel治疗获益(图4)。在既往接受过贝林妥欧单抗的患者(n=38)与既往未接受过的患者(n=40)中,中位OS分别为15.9个月(95% CI,8.3个月-26.0个月)与60.4个月(95% CI,18.6个月-NE);在既往接受过奥加伊妥珠单抗的患者(n=17)与既往未接受过的患者(n=61)中,中位OS分别为8.8个月(95% CI,2.2个月-34.1个月)与38.9个月(95% CI,18.6个月-NE)。
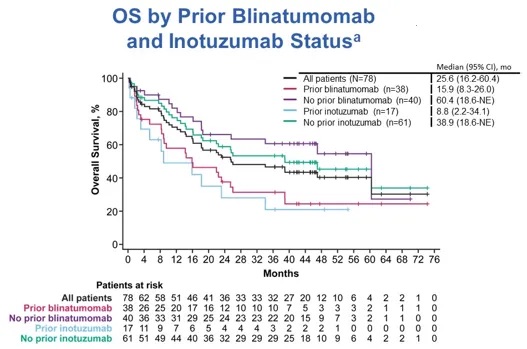
图4 基于既往接受贝林妥欧单抗与奥加伊妥珠单抗治疗情况的OS亚组分析,采用Kaplan-Meier分析评估
基于ZUMA-3研究的关键亚组,评估48个月OS率(图5)。在所有患者人群中,48个月OS率为40%(95% CI,28%-52%)。绝大多数亚组之间,48个月OS率相似,但既往接受过贝林妥欧单抗或奥加伊妥珠单抗治疗的患者中较低,分别为24%与21%。
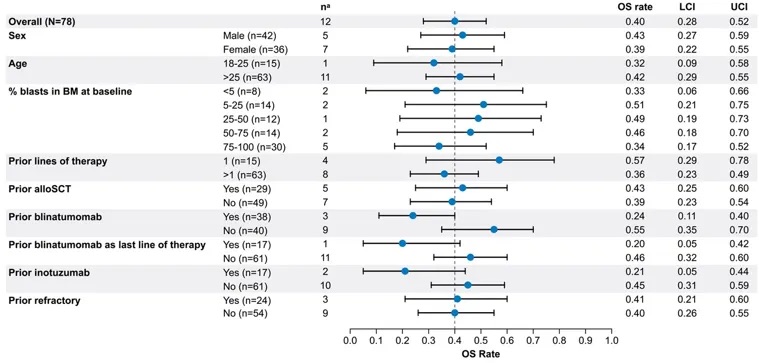
图5 不同亚组的48个月OS率分析
04 安全性结果
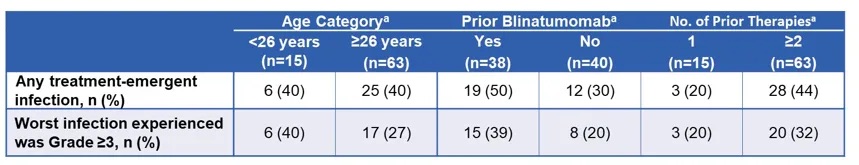
本次随访期间,未观察到新发生的不良事件或死亡事件。比较有趣的是,年龄<26岁的患者、既往接受过贝林妥欧单抗治疗的患者、以及既往治疗≥2线的患者中,≥3级感染发生率较高(表1)。
表1 ZUMA-3研究中治疗相关的感染情况亚组分析
随访期间,与疾病进展(PD)无关的死亡率为25%(n=17),其中仅2例死亡与Brexu-cel治疗相关。此外,48个月时的非复发死亡率(NRM)为25%(95% CI,15%-37%),其中35%的NRM事件发生在接受过allo-SCT的患者中;48个月时复发相关的死亡率为34%(95% CI,24%-45%)。
05研究结论
ZUMA-3研究表明,经过长达4年以上的随访,无论年龄、既往治疗线数、或后续是否接受allo-SCT,R/R B-ALL患者均可从Brexu-cel治疗持续获益。此外,本次随访期间未观察到新的安全信号。考虑到研究样本量较小、患者基线特征不匹配可能影响了对研究结果的解读,未来需要进一步研究以全面评估年龄、既往治疗情况和/或allo-SCT对接受Brexu-cel治疗的患者结局的影响。
吕萌副教授解读
经挽救性治疗的R/R B-ALL患者疗效与预后仅不佳。近年来,CAR-T细胞疗法取得了巨大进展,由于CD19表达均匀,几乎成为了B-ALL理想的靶抗原[7]。在过去,ZUMA-3研究已发布两年随访结果,证实了一种抗CD19 CAR-T细胞疗法Brexu-cel可以为R/R B-ALL患者人群提供具有临床意义的生存意义,且不良事件可控[8]。
本次大会上公布了ZUMA-3研究的长达4年以上的随访结果,并证实了无论年龄、既往治疗线数、或后续allo-SCT状态如何,患者均可从Brexu-cel治疗持续获得长达4年以上的生存获益,且R/R B-ALL患者人群中未观察到新发生的不良事件或死亡事件,提示Brexu-cel治疗后不良事件可控。期待Brexu-cel未来公布更长期的疗效与安全性数据,为CAR-T细胞疗法在R/R B-ALL的临床应用提供更可靠的证据支持。
江浩教授点评
CAR-T作为一种新型抗肿瘤免疫疗法,已成为治疗包括淋巴瘤及白血病在内的复发难治性血液系统肿瘤的重要新方法,目前已在B细胞恶性肿瘤患者中显示出卓越的效果。Brexu-cel作为一种自体抗CD19 CAR-T细胞疗法,在本研究证实其能为R/R B-ALL患者人群提供显著的长期生存获益,且不良事件可控。
Brexu-cel在中国的本地化产品FKC889治疗R/R B-ALL的注册临床试验正在进行中[6]。期待中国的FKC889也能为中国患者带来如此卓越的疗效,也期待Brexu-cel未来公布更长期的随访数据,为指导CAR-T细胞疗法在R/R B-ALL的临床应用提供更久、更全面的证据支持,为更多患者带来获益。

江浩 教授
北京大学人民医院血液研究所病区主任
中华医学会血液学分会白血病淋巴瘤专业学组委员
中国医疗保健国际交流促进会血液学分会常务委员
中国老年医学会血液学分会常务委员
中国抗癌协会血液肿瘤专委会委员
主持科技部重点研发计划项目、首都特色专项基金等国家省部级项目
以第一作者或者通讯作者等发表中英文论著50余篇

吕萌 副教授
北京大学人民医院、北京大学血液病研究所副教授、副主任医师、硕导
北京大学血液病学系副主任、北京大学人民医院临床试验机构副主任
美国Memorial Sloan-Kettering Cancer Center 访问学者
美国血液年会(ASH) 2022/2023 移植分会场主席
欧洲骨髓移植(EBMT) 全球青年大使
人民日报第三届“国之名医--青年新锐 ”、首都卫生健康首届“十大未来之星”
”、首都卫生健康首届“十大未来之星”
北京市科技新星、主持国自然、国家重点研发等课题
J Hematol Oncol, Cell Mol Immunol, Clin Cancer Res, Leukemia等一作、通讯作者SCI


