
2024 ASCO|赵军教授:走向精准,ADAURA研究MRD分析结果公布,助力优化奥希替尼辅助治疗策略
随着精准治疗的不断发展,表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)在晚期非小细胞肺癌 (NSCLC)的治疗中大放异彩,其治疗线数也逐渐前移,推动了早期EGFR敏感突变(Ex19del/L858R)NSCLC的术后辅助靶向治疗变革。ADAURA研究是术后辅助靶向治疗领域的里程碑式研究,2024年美国临床肿瘤学会(ASCO)年会进一步公布了ADAURA研究微小残留病灶(MRD)分析结果[1]。值此之际,医脉通特邀苏州大学附属第一医院赵军教授解读ADAURA研究MRD分析结果,展望其对IB-IIIA期EGFR敏感突变NSCLC患者奥希替尼
(NSCLC)的治疗中大放异彩,其治疗线数也逐渐前移,推动了早期EGFR敏感突变(Ex19del/L858R)NSCLC的术后辅助靶向治疗变革。ADAURA研究是术后辅助靶向治疗领域的里程碑式研究,2024年美国临床肿瘤学会(ASCO)年会进一步公布了ADAURA研究微小残留病灶(MRD)分析结果[1]。值此之际,医脉通特邀苏州大学附属第一医院赵军教授解读ADAURA研究MRD分析结果,展望其对IB-IIIA期EGFR敏感突变NSCLC患者奥希替尼 辅助靶向治疗的积极意义。
辅助靶向治疗的积极意义。
ADAURA研究MRD分析结果公布,助力奥希替尼辅助治疗的复发监测
术后辅助化疗是早期肺癌患者延长术后生存的重要治疗手段,但5年OS率仅提高5.4%,患者获益难以继续从中获得突破[2]。ADAURA研究是首个探讨三代EGFR-TKI奥希替尼辅助治疗可切除IB-IIIA期(AJCC第7版)EGFR敏感突变NSCLC的III期研究,5年随访的OS结果显示,奥希替尼辅助治疗IB-IIIA期NSCLC患者OS获益显著(OS HR=0.49,P<0.001;5年OS率:88% vs 78%),开启了早期肺癌术后辅助靶向治疗的新篇章[3]。与此同时,在ADAURA研究中,辅助治疗3年后的无病生存期(DFS)事件发生率呈增长态势,且41%复发患者接受奥希替尼治疗,提示部分患者可能需要接受更长时间的辅助治疗[4]。
基于此,研究者通过血浆循环肿瘤DNA(ctDNA)、肿瘤先验(tumor-informed)MRD技术以预测肿瘤复发。从随机入组至ADAURA研究结束后,受试者在基线、每12周治疗时以及停止/完成奥希替尼辅助治疗后(第12、24周,而后每24周/次直至5年)接受血浆ctDNA检测(图1)。

图1.辅助治疗期间和辅助治疗结束后进行MRD检测
结果显示,奥希替尼组(n=112)中有5例患者在基线时即检测出MRD,其中4例患者经奥希替尼辅助治疗后变为阴性,该数值在安慰剂组分别为13和0(图2)。在辅助治疗过程中,MRD检测敏感度及特异性分别为65%和95%,并且可在DFS事件前中位4.7个月检测出MRD(图3)。
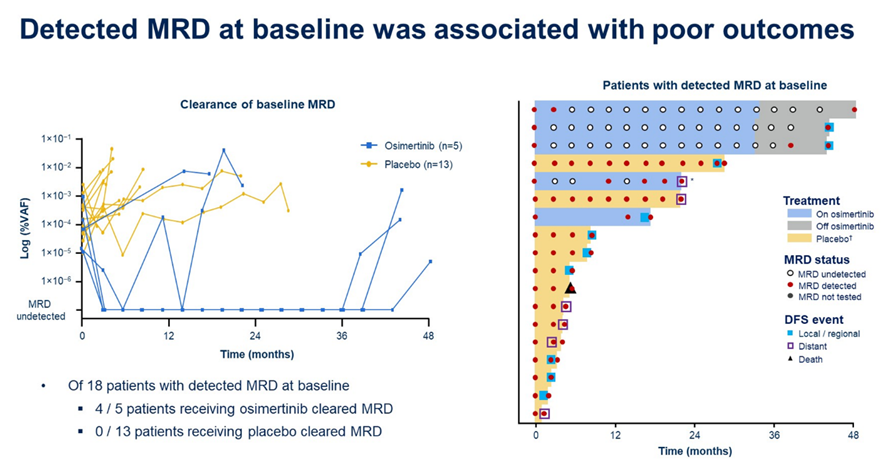
图2.基线可检测出的MRD
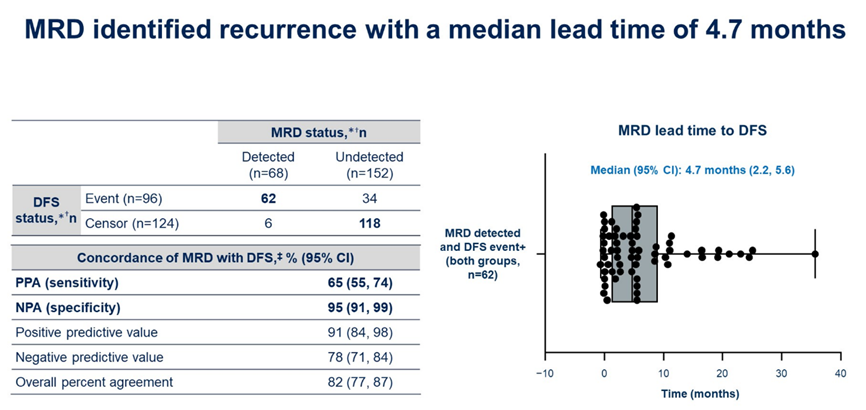
图3.中位前置时间为4.7个月
分别经过44.2个月以及19.1个月中位随访,奥希替尼组及安慰剂组24个月无MRD/DFS事件率分别为91%和46%,36个月无MRD/DFS事件率分别为86%和36%(HR=0.23)(图4)。此外,奥希替尼组有28例患者在基线后发生MRD/DFS事件,其中19例为辅助治疗结束后,且大多(11/19,58%)发生在治疗结束后12个月内(图5)。随访发现,奥希替尼组辅助治疗结束后12个月和24个月无MRD/DFS事件率分别为80%和66%(图6)。
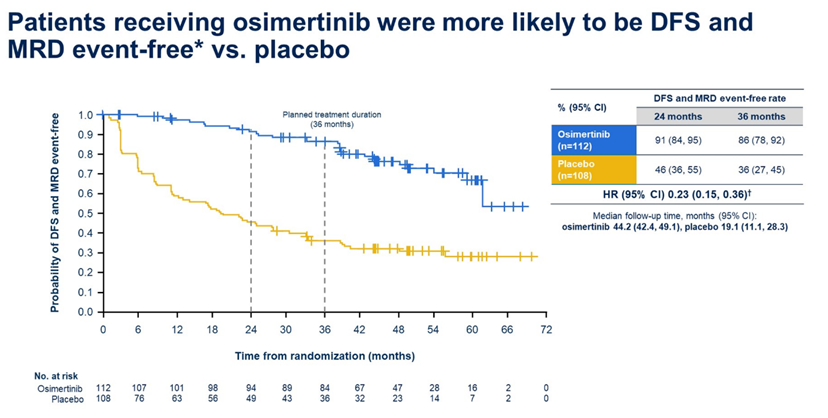
图4. 无MRD/DFS事件率
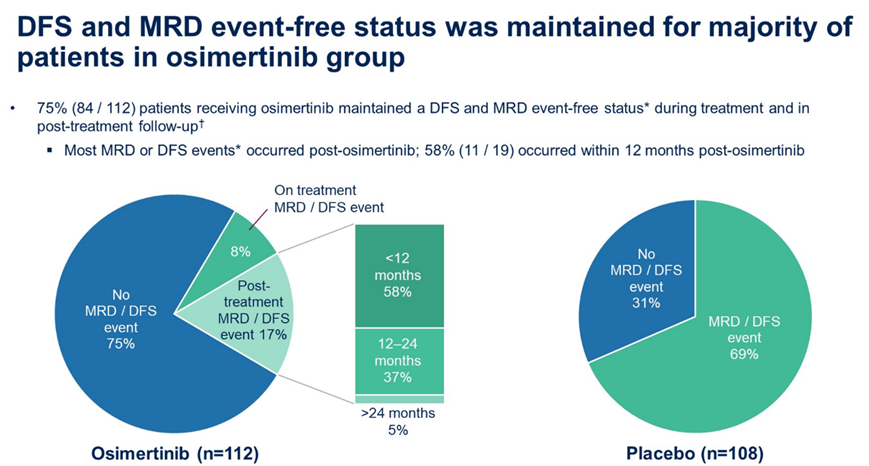
图5. MRD/DFS事件大多发生在奥希替尼辅助治疗完成后

图6.奥希替尼辅助治疗完成后随访:无MRD/DFS事件率
综上所述,在多数患者中,MRD阳性先于DFS事件发生,中位前置时间为4.7个月。多数患者的MRD状态在奥希替尼辅助治疗过程中保持阴性,且大部分(19/28)MRD/DFS事件发生在辅助治疗结束后,其中58%发生在治疗结束后12个月内。MRD检测可能可以识别出从更长时间奥希替尼辅助治疗中获益的潜在人群。
专家点评
崭露头角,新型生物标志物MRD助力早期NSCLC走向精准
NSCLC患者接受完全切除术后,超过50%的肿瘤复发或转移发生于术后前2年,但术后3-5年复发和转移风险仍偏高,直到术后5年后肿瘤复发和转移风险才显著降低,但仍有复发风险[2]。准确及时地确定高复发风险以及预后较差的患者可能为早期NSCLC患者的提前临床干预提供机会。在早期肺癌行根治性切除术后,分子层面上具有残留病灶的患者往往很难通过传统监测方法发现,病理性标志物也受诸多因素干扰,不能准确预测高危人群。
MRD能够早于传统监测方法评估肺癌术后复发风险以及预后疗效,指导辅助治疗决策的制定。多项研究提示,术后MRD状态可为NSCLC术后复发风险提供参考[5-7]。与MRD阴性患者相比,术后MRD阳性患者复发风险显著更高,辅助治疗后MRD阳性患者复发风险也显著更高(HR=0.32,95% CI 1.3–8.2,P<0.05),提示辅助治疗后MRD状态可以预测患者疾病复发风险[5]。我国首个《非小细胞肺癌分子残留病灶专家共识》也强调了MRD在复发监测中的重要性,共识建议:早期非小细胞肺癌患者根治性切除术后,MRD阳性提示复发风险高,需进行密切随访管理,建议每3-6个月进行一次MRD检测(共识级别:2A)[8]。目前,以ctDNA为标志物的液态活检技术进行MRD检测的相关研究在早期NSCLC复发风险预测的证据不断积累,已成为临床重点关注的方向。
初试锋芒,MRD监测或将为奥希替尼辅助治疗带来变革
既往已公布的ADAURA研究表明,奥希替尼辅助治疗高达88%的5年OS率使IB-IIIA期EGFR敏感突变NSCLC患者进入治愈时代,奥希替尼已成为IB-IIIA期EGFR敏感突变NSCLC患者的辅助治疗“金标准”。但如何进一步优化辅助治疗策略,提高患者获益仍是当前研究的热点。本次大会公布的ADAURA研究MRD分析提示,MRD检测对于早期NSCLC患者的复发监测具有重要意义。在大多数患者中,MRD阳性早于DFS事件发现肿瘤复发,中位前置时间为4.7个月,提示MRD阳性相较于影像学检查可提前预测复发。奥希替尼组中在基线检测出MRD阳性的5例患者经奥希替尼辅助治疗后有4例变为MRD阴性,而安慰剂组无改善,提示基线MRD阳性即高风险患者更应接受奥希替尼辅助治疗,未来或可根据MRD分析对患者的复发风险进行分层,从而实现不同复发风险的患者的分级诊疗。此外,进一步分析MRD/DFS事件发生模式,研究者发现奥希替尼组有28例患者在基线后发生MRD/DFS事件,其中19例(68%)为奥希替尼辅助治疗结束后,且大部分(11/19,58%)发生在奥希替尼辅助治疗结束后12个月内,提示部分患者可能需要接受>3年的奥希替尼辅助治疗,MRD检测可能识别出从更长时间的奥希替尼辅助治疗中获益的潜在人群。
奥希替尼辅助治疗的最佳用药时限仍在探索,正在进行的II期TARGET试验评估了奥希替尼在完全切除的II-IIIB期EGFR突变NSCLC患者中5年的疗效,期待该结果的公布,为奥希替尼的最佳辅助治疗时长提供新的证据[9]。同时,MRD作为适应性治疗的标志物,已有多个依据MRD状态指导辅助靶向治疗的前瞻性研究正在开展(如NCT05079022、NCT06053099等),期待未来更多循证医学证据的公布,进一步明确MRD对治疗加减法的指导[10]。
目前,MRD与肺癌患者术后复发之间相关性的证据也不断累积,已有多项回顾性的数据看到MRD在治疗指导中的价值,MRD距离临床实践越来越近,但也面临着诸多挑战。MRD检测可更早发现疾病复发,但如何利用疾病复发的早发现为患者带来临床获益需进一步研究。临床该如何有效介入MRD带来的前置时间、患者可及性、MRD标准化等问题仍需要探索,未来,我们需在提升MRD检测灵敏度和研发优化策略等方面继续着力,期待以后MRD技术的日趋成熟和临床研究的结果带来的临床价值相继呈现,助力MRD成为非常重要的分子检测工具,帮助指导肺癌的精准治疗和临床决策。




