
2024 ASCO中国风丨杨红健、俞星飞教授:患者来源的肿瘤样细胞簇指导乳腺癌新辅助治疗方案选择,助力个体化临床决策
2024年美国临床肿瘤学会(ASCO)年会于5月31日-6月4日在芝加哥盛大召开,作为全球最有影响力的临床肿瘤学会议之一,ASCO年会每年都汇集了众多世界一流的肿瘤学专家,共同探讨当前国际最前沿的研究发现和临床试验成果。近年来,精准治疗在抗肿瘤领域大放异彩,尤其是生物标志物检测的兴起对肿瘤治疗的推动作用,受到国内外学者广泛关注。本次大会上,浙江省肿瘤医院杨红健、俞星飞教授团队带来一项前瞻性随机研究(NCT05103293)壁报报道(Poster Session,Abstr Numb. 581),聚焦于患者来源的肿瘤样细胞簇(PTC)对乳腺癌 新辅助治疗方案的个体化指导,医脉通小编整理如下,以飨读者。
新辅助治疗方案的个体化指导,医脉通小编整理如下,以飨读者。
研究背景
基于曲妥珠单抗 和帕妥珠单抗
和帕妥珠单抗 的新辅助治疗(NAT)可使人表皮因子受体2(HER2)阳性乳腺癌患者获得高达40~60%的病理完全缓解(pCR)率。同时,由于不同的作用机制,曲妥珠单抗与其他细胞毒性药物(如蒽环类、铂类)或小分子酪氨酸激酶抑制剂(如吡咯替尼
的新辅助治疗(NAT)可使人表皮因子受体2(HER2)阳性乳腺癌患者获得高达40~60%的病理完全缓解(pCR)率。同时,由于不同的作用机制,曲妥珠单抗与其他细胞毒性药物(如蒽环类、铂类)或小分子酪氨酸激酶抑制剂(如吡咯替尼 )的联合使用,可能有助于克服肿瘤耐药性并改善pCR。在既往研究中,患者来源的肿瘤样细胞簇(PTC)被证实是一种临床实践中较为准确的药物效应预测模型。本项前瞻性随机试验,旨在探究基于PTC的体外药敏指导治疗方案选择是否可以改善NAT对HER2阳性乳腺癌的治疗效果(NCT05103293)。
)的联合使用,可能有助于克服肿瘤耐药性并改善pCR。在既往研究中,患者来源的肿瘤样细胞簇(PTC)被证实是一种临床实践中较为准确的药物效应预测模型。本项前瞻性随机试验,旨在探究基于PTC的体外药敏指导治疗方案选择是否可以改善NAT对HER2阳性乳腺癌的治疗效果(NCT05103293)。
研究方法
研究纳入来自浙江省肿瘤医院,年龄为18至70岁的、免疫组化(IHC)检测HER2阳性或经IHC检测后通过荧光原位杂交(FISH)确认的HER2阳性、计划接受NAT的T2-4/N0-2/M0浸润性乳腺癌女性患者。患者入组后随机(1:1)分入试验组和对照组。试验组接受PTC检测并根据PTC结果指导NAT方案选择,对照组则接受医生选择的NAT治疗方案。试验组患者进行PTC药敏试验 ,并选择候选方案中PTC体外杀伤率最高的方案(最低临界值为30%)。主要研究终点是比较两组的pCR,采用Fisher精确检验(双侧α=0.05)进行评估。次要研究终点包括Miller-Payne(MP)4~5级比例、客观缓解率(ORR)、无病生存期(DFS)及总生存期(OS)。
,并选择候选方案中PTC体外杀伤率最高的方案(最低临界值为30%)。主要研究终点是比较两组的pCR,采用Fisher精确检验(双侧α=0.05)进行评估。次要研究终点包括Miller-Payne(MP)4~5级比例、客观缓解率(ORR)、无病生存期(DFS)及总生存期(OS)。

图1. 研究流程
研究结果
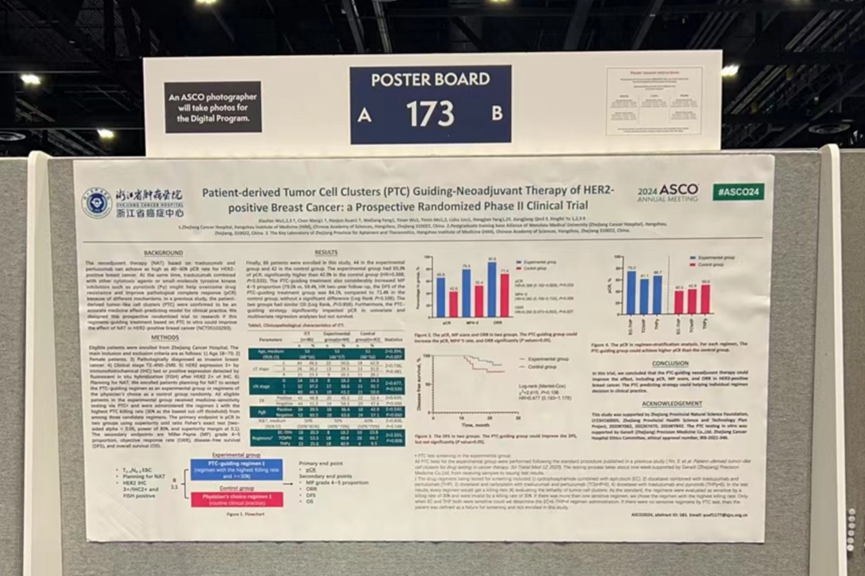
最终纳入86例患者进入意向性人群分析(ITT),其中试验组44例,对照组42例。
表1. ITT临床病理特征
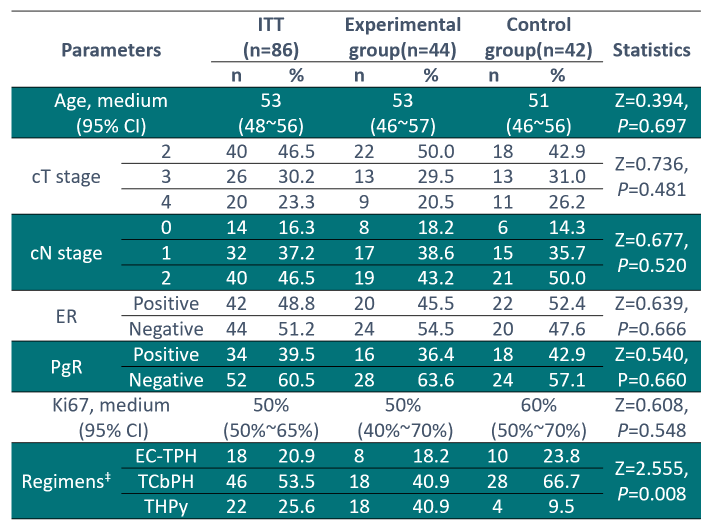
试验组pCR为65.9%,显著高于对照组42.9%(HR=0.388,P=0.033)。PTC指导治疗还显著增加了MP4~5比例(79.5% vs.59.4%)和客观缓解率(90.9% vs. 71.4%),试验组的2年DFS为84.1%,对照组为71.4%,无显著差异(P=0.106)。两组的OS相似(P=0.958)。此外,PTC指导策略在单变量和多变量回归分析中显著影响pCR,但不影响OS。
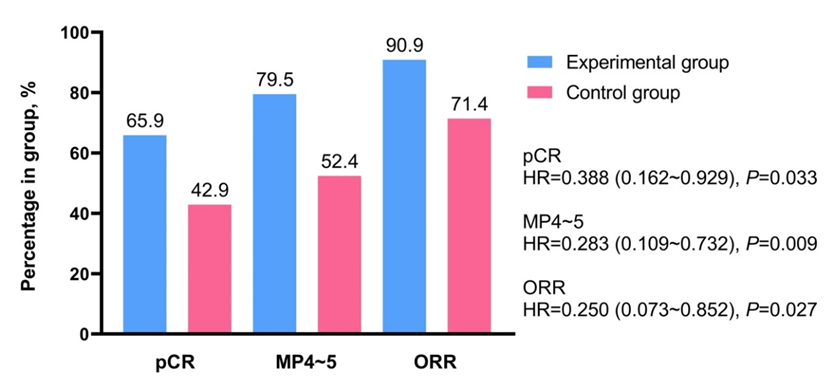
图2. 两组患者的pCR、MP评分及ORR。试验组可显著提高pCR、MP4~5率和ORR (P <0.05)
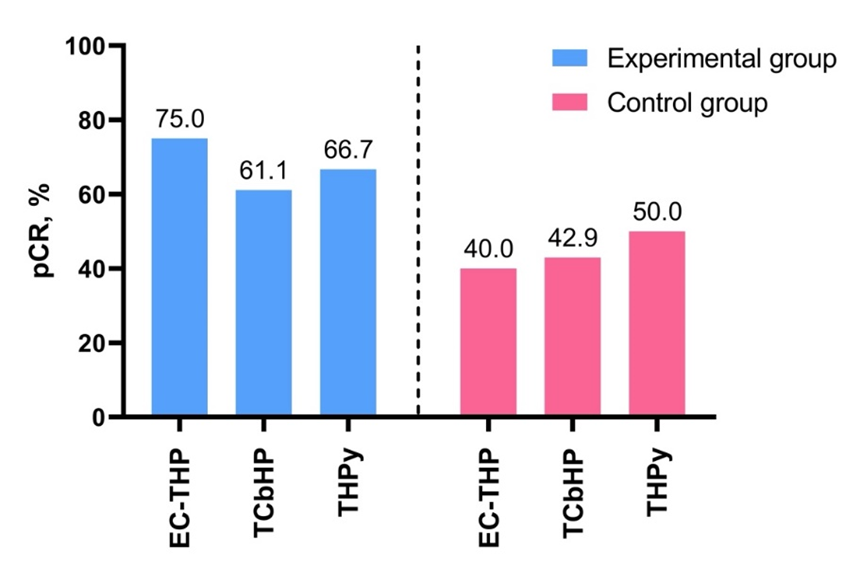
图3. 两组的DFS,试验组可改善DFS,但无显著性差异(P>0.05)
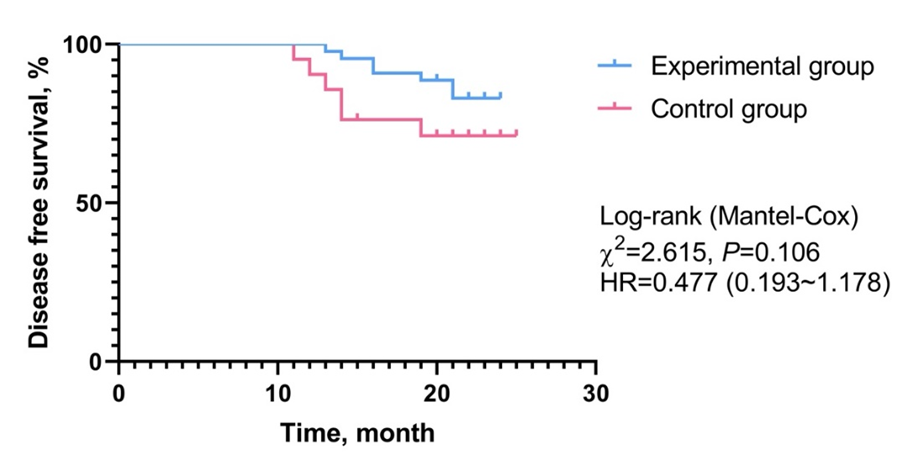
图4. 方案分层分析中的pCR。各方案中,试验组的pCR均高于对照组
研究结论
PTC指导的NAT可以改善HER2阳性乳腺癌的pCR、MP评分和ORR,且PTC预测策略有助于临床实践中个体方案的决策。
【专家解读和探讨】
1. 新辅助治疗目前已成为HER2阳性早期和局部晚期乳腺癌最为重要的治疗方式之一,紫杉类和曲妥珠单抗联合也是临床中最为常用的基本药物组合,在此基础上,可以联合其他大分子单抗(帕妥珠单抗)、不同的细胞毒药物(蒽环类、铂类)或者小分子酪氨酸酶抑制剂(吡咯替尼)是当前中国地区指南和共识的主要推荐方案,尽管这几种组合均可在临床实践中获得较高的pCR率(40%~60%),但其药理和克服交叉耐药的机制不尽相同,依然会存在个体化的疗效差异,然而目前缺乏头对头的临床试验比较方案的疗效差异,临床上更没有很好的预测模型或者标记物帮助医生进行方案的选择。
2. 我们检索了目前可能的预测模型或者药敏模型,这些模型具有以下特点:1)绝大部分的模型获得可以指导临床应用的药敏报告需要长达3-4周的时间窗;2)基于动物的药敏模型由于实验室和参数条件存在个体报告的差异;3)PDX模型尽管具备活体反应性,但与人体反应一致性评价数据尚难以为临床实践应用,有一定的失败率且成本高昂;4)PDO模型有一定的实践价值,但缺少间质细胞型,尚需要一定时间的临床前研发完善和验证。PTC模型是一种新型的患者来源肿瘤细胞簇模型,在之前的研究中体外肿瘤微球显示出培养的高效性,并有较高的成功率,保持了原代肿瘤细胞的完整性(保留了肿瘤上皮细胞、巨噬细胞和成纤维细胞成分等),基因型蛋白表型与原肿瘤组织高度一致,且初步临床研究验证了体外给药与人体药物反应的一致性,因此成为一种具有潜在临床实践价值的体外药敏预测模型。我们设计该研究,结果证实了PTC在体外实现了较好的预测效果,选择药敏高杀伤率的方案有可能实现临床更为高效的个体化用药。
3. 本项研究是II期探索性的随机对照研究,尽管获得了初步的阳性结果,但依然存在一些局限性:1)由于PTC是体外模型,没有大量的免疫细胞和环境支持免疫治疗效果,对于单抗类和免疫治疗的ADCC作用可能存在明显低估;2)本研究当时的设计基于最大中国人群样本的PEONY(紫衫和曲帕双靶的39.3%pCR率)试验进行研究样本预设和终点预设,而当前的临床实践中,双靶治疗业已成为标准的治疗方案,因此整体的pCR率能达到优效性终点也具有时代局限性;3)对于残余病灶的检测我们认为可能更具有辅助治疗的指导和研究价值,但我们小样本的探索后发现残余病灶的PTC培养成功率偏低,主要原因在于大量的癌细胞处于药物反应期内,影响培养活性,且对药敏检测产生混杂影响。
基于以上研究结果和探讨,PTC是一种值得进一步完善和探索的临床药敏模型,未来还需要设计多中心大样本的三期临床试验来进行高级别证据的验证,同时还需要探索新型的培养参数以补全免疫治疗药物的相关疗效预测价值。




