
ASCO LBA重磅公布,未来CDK4/6i耐药后HR+/HER2- 晚期乳腺癌治疗策略如何选择?
在HR+/HER2-晚期乳腺癌 的治疗中,细胞周期蛋白依赖性激酶4和6抑制剂(CDK4/6i)与内分泌治疗的联合应用可以显著改善患者的预后,降低疾病复发风险。然而即便如此,大多数患者最终仍会遭遇疾病进展。当前,如何为一线CDK4/6i治疗后进展的患者制定后续治疗策略,成为了临床医生面临的挑战。据此,医脉通特别邀请天津医科大学肿瘤医院郝春芳教授,基于2024年ASCO最新研究进展,分享并探讨HR+/HER2-晚期乳腺癌一线CDK4/6i耐药后的治疗选择。
的治疗中,细胞周期蛋白依赖性激酶4和6抑制剂(CDK4/6i)与内分泌治疗的联合应用可以显著改善患者的预后,降低疾病复发风险。然而即便如此,大多数患者最终仍会遭遇疾病进展。当前,如何为一线CDK4/6i治疗后进展的患者制定后续治疗策略,成为了临床医生面临的挑战。据此,医脉通特别邀请天津医科大学肿瘤医院郝春芳教授,基于2024年ASCO最新研究进展,分享并探讨HR+/HER2-晚期乳腺癌一线CDK4/6i耐药后的治疗选择。

从CAPItello291研究到postMONARCH研究,
CDK4/6i 耐药后治疗选择再思考
众所周知,HR+/HER2-乳腺癌约占全部乳腺癌的60%~70%,是晚期乳腺癌中最常见的亚型。目前国内外指南一致推荐,CDK4/6i联合内分泌治疗作为HR+/HER2-晚期乳腺癌的一线标准治疗,但一线CDK4/6i治疗失败后尚无标准治疗推荐方案。这一局限性主要源于既往可选方案均缺乏针对一线CDK4/6i经治人群的大型III期研究数据支持,从而导致后续治疗策略的不确定性。
然而,2022年SABCS大会上公布的 CAPItello291研究[1]打破了这一局面。CAPItello291研究[1]是首个大量入组CDK4/6i经治HR+/HER2-晚期乳腺癌人群的大型III期临床试验,其中CDK4/6i经治患者约70%。结果显示,Capivasertib联合氟维司群 组较氟维司群单药组将患者中位无进展生存期(mPFS)延长了2倍(7.2个月 vs 3.6个月, HR=0.60),疾病进展风险降低40%,其中PIK3CA/AKT1/PTEN突变人群mPFS获益更为显著(7.3个月vs 3.1个月, HR=0.50),该结果为CDK4/6i经治患者的治疗提供了新的视角和选择方案。
组较氟维司群单药组将患者中位无进展生存期(mPFS)延长了2倍(7.2个月 vs 3.6个月, HR=0.60),疾病进展风险降低40%,其中PIK3CA/AKT1/PTEN突变人群mPFS获益更为显著(7.3个月vs 3.1个月, HR=0.50),该结果为CDK4/6i经治患者的治疗提供了新的视角和选择方案。
继CAPItello291研究之后,本年度ASCO大会以LBA的形式重磅公布了第二个针对CDK4/6i经治HR+/HER2-晚期乳腺癌患者的大型III期临床研究——postMONARCH研究[2]。结果显示,阿贝西利 联合氟维司群较氟维司群单药组可改善患者的PFS(6.0个月 vs 5.3个月, HR=0.73), 疾病进展风险降低27%。该研究探讨了既往使用CDK4/6i治疗进展后CDK4/6i再挑战的治疗策略,提供了关于跨线治疗的新证据。这两项研究不仅打破了现状,更引发了临床对于一线CDK4/6i治疗进展后应如何选择治疗方案的深入思考。
联合氟维司群较氟维司群单药组可改善患者的PFS(6.0个月 vs 5.3个月, HR=0.73), 疾病进展风险降低27%。该研究探讨了既往使用CDK4/6i治疗进展后CDK4/6i再挑战的治疗策略,提供了关于跨线治疗的新证据。这两项研究不仅打破了现状,更引发了临床对于一线CDK4/6i治疗进展后应如何选择治疗方案的深入思考。
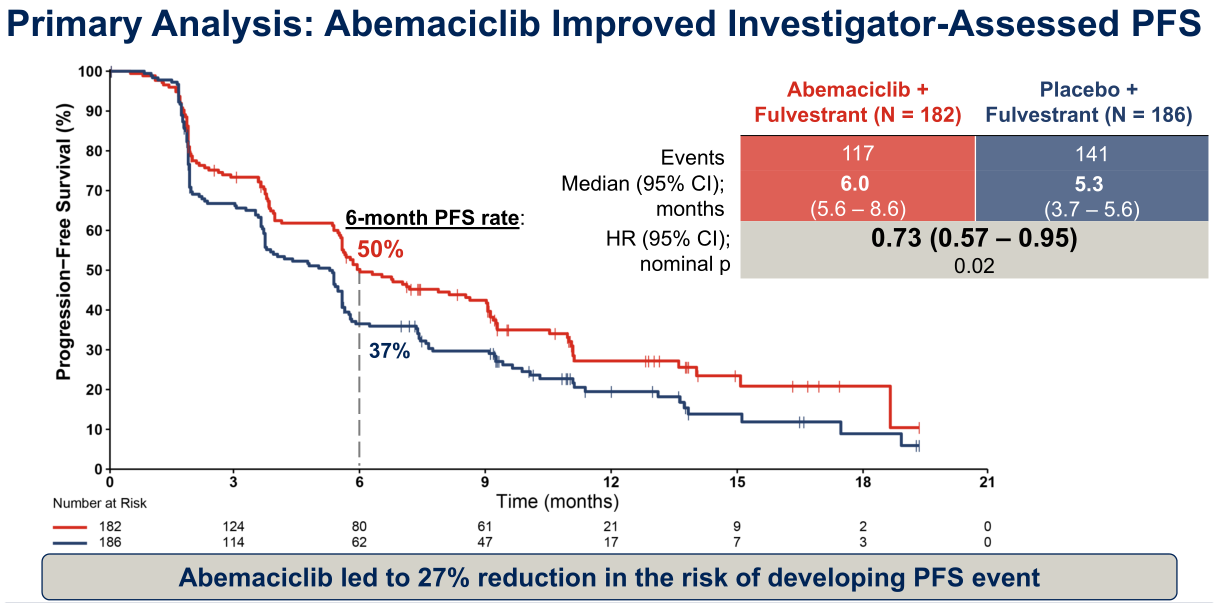
图1 postMONARCH研究主要分析结果
从临床现状到研究证据,
多维度解析CDK4/6i耐药后治疗策略的选择
根据报告,从中国临床现状来看,在一线CDK4/6i治疗进展后进行CDK4/6i再挑战约占二线治疗方案的35%,分析其原因可能包括CDK4/6i的可及性较高和临床应用经验较为丰富。然而,从循证医学的角度来看,现有的随机II期研究数据结果并不一致。既往MAINTAIN研究发现[3],在既往服用CDK4/6i(87%哌柏西利 )进展后,跨线再挑战瑞波西利
)进展后,跨线再挑战瑞波西利 联合内分泌治疗可改善PFS(5.29个月 vs 2.76个月,HR=0.57);但同为CDK4/6i经治(90.9%哌柏西利)失败,之后继续挑战哌柏西利联合内分泌治疗的PACE研究[4]却并未显示PFS获益(4.6个月 vs 4.8个月,HR=1.11,P=0.62)。PALMIRA研究[5]也提示在一线哌柏西利耐药后,哌柏西利维持治疗联合内分泌治疗并不能显著提升PFS(4.2个月 vs 3.6个月,HR=0.8,P=0.206)。因此,CDK4/6i再挑战的效果存在一定的不确定性,这使得临床医生在选择再挑战方案时面临困惑,某种程度上是一种“没有选择的选择”。
联合内分泌治疗可改善PFS(5.29个月 vs 2.76个月,HR=0.57);但同为CDK4/6i经治(90.9%哌柏西利)失败,之后继续挑战哌柏西利联合内分泌治疗的PACE研究[4]却并未显示PFS获益(4.6个月 vs 4.8个月,HR=1.11,P=0.62)。PALMIRA研究[5]也提示在一线哌柏西利耐药后,哌柏西利维持治疗联合内分泌治疗并不能显著提升PFS(4.2个月 vs 3.6个月,HR=0.8,P=0.206)。因此,CDK4/6i再挑战的效果存在一定的不确定性,这使得临床医生在选择再挑战方案时面临困惑,某种程度上是一种“没有选择的选择”。
从作用机制上看,CDK4/6i耐药的机制多种多样,包括雌激素 受体(ER)/孕激素
受体(ER)/孕激素 受体(PR)表达缺失、细胞周期激酶如Cyclin E过度表达、PI3K/AKT/mTOR(PAM)等其他通路激活、微环境改变等。在HR+/HER2-乳腺癌的临床前模型中,阿贝西利与帕博西利或瑞波西利之间的交叉耐药性是不完全的,这支持了药物轮换或使用下一代CDK靶向药物的概念。然而,临床高达50%的HR+晚期乳腺癌存在PAM通路异常,其中常见基因突变PIK3CA、AKT1和PTEN等与内分泌治疗和CDK4/6i耐药密切相关。临床前研究表明,在获得性耐药环境下,CDK4/6i由于失去对Rb信号的依赖而不再有效地阻断细胞生长;然而,通过靶向PAM通路信号可有效阻断CDK4/6i耐药细胞的增殖。
受体(PR)表达缺失、细胞周期激酶如Cyclin E过度表达、PI3K/AKT/mTOR(PAM)等其他通路激活、微环境改变等。在HR+/HER2-乳腺癌的临床前模型中,阿贝西利与帕博西利或瑞波西利之间的交叉耐药性是不完全的,这支持了药物轮换或使用下一代CDK靶向药物的概念。然而,临床高达50%的HR+晚期乳腺癌存在PAM通路异常,其中常见基因突变PIK3CA、AKT1和PTEN等与内分泌治疗和CDK4/6i耐药密切相关。临床前研究表明,在获得性耐药环境下,CDK4/6i由于失去对Rb信号的依赖而不再有效地阻断细胞生长;然而,通过靶向PAM通路信号可有效阻断CDK4/6i耐药细胞的增殖。
从临床数据来看,对于CDK4/6i经治的患者,postMONARCH研究中阿贝西利的绝对获益只有0.7个月(HR=0.73);而 CAPItello291研究中Capivasertib的绝对获益为3.6个月(HR=0.60),且不受CDK4/6i经治的影响,既往CDK4/6i经治人群的HR为0.59 。此外,相比postMONARCH研究,CAPItello291研究纳入患者的基线特征更差,Capivasertib组有89%的患者既往接受过≥1线治疗,69.6%的患者接受过CDK4/6i治疗(CDK4/6i治疗≥12个月占比约60%),69%的患者既往接受过化疗,43.9%的患者伴肝转移。而postMONARCH研究中阿贝西利组100%的患者都是在CDK4/6i一线初始治疗后直接入组,71%的患者CDK4/6i治疗≥12个月,有37%的患者伴肝转移。同时,虽均为接受氟维司群单药治疗,CAPItello291研究中CDK4/6i经治后患者的中位PFS为2.6个月,postMONARCH研究中患者的中位PFS高达5.3个月,提示该研究纳入的CDK4/6i经治患者对于内分泌治疗可能相对敏感。不仅如此,从前线CDK4/6i治疗的亚组分析数据中可以看到,阿贝西利组的PFS获益主要源自于一线以帕博西利为主的亚组(HR=0.62, 95%CI 0.44-0.86),其他一线瑞波西利(HR=1.01,95%CI 0.67-1.51)和一线阿贝西利亚组(HR=0.66, 95%CI 0.27-1.64)均有获益趋势,但95%CI均跨1。但是在中国实际临床实践中,一线应用阿贝西利的情况更为多见(约55%)。
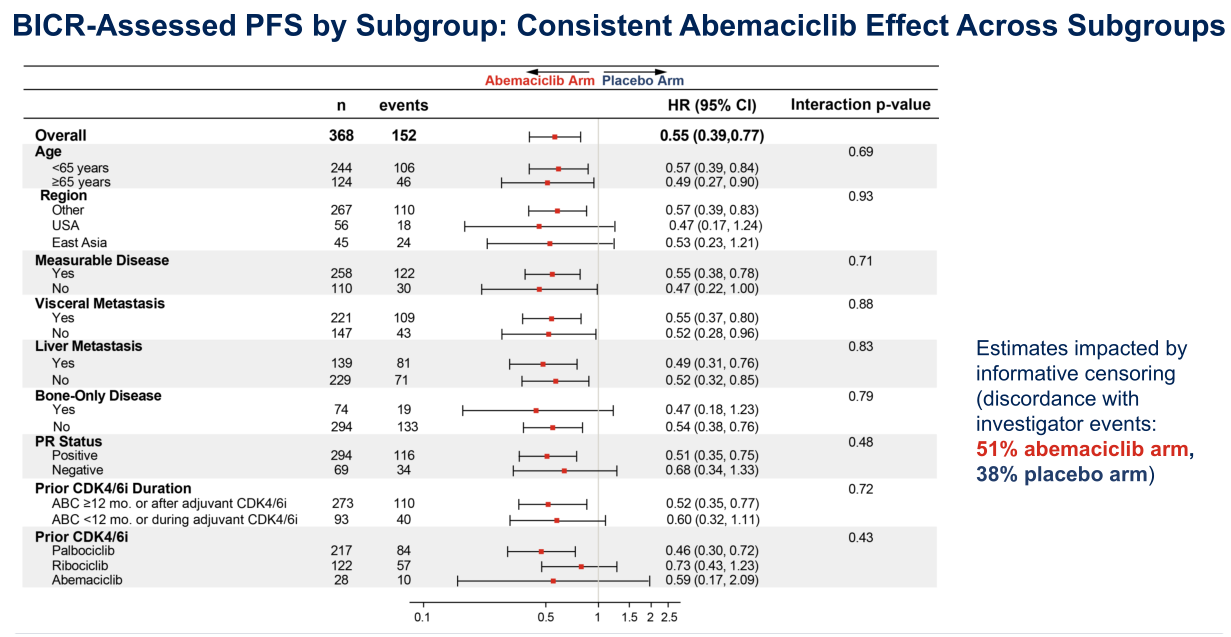
图2 postMONARCH研究亚组分析结果
值得一提的是,PAM通路突变的患者往往内分泌疗效不佳[6,7]。在CAPItello291研究中,同是接受氟维司群单药治疗,PIK3CA/AKT1/PTEN突变患者的中位PFS低于未突变患者(3.1个月 vs 3.7个月)。对于PIK3CA/AKT1/PTEN突变人群,Capivasertib联合氟维司群组较氟维司群单药组的mPFS获益更为显著(7.3个月vs 3.1个月, HR=0.50;95%CI 0.38–0.65;P<0.001);其中CDK4/6i经治亚组的HR为0.49。在postMONARCH研究中,PIK3CA/AKT1/PTEN突变组与未突变组之间的PFS获益无明显差异,HR分别为0.86(95%CI 0.60-1.23)和0.73(95%CI 0.51-1.06)。需要注意的是,postMONARCH研究中研究者评估的PFS获益和盲态独立评审委员会(BIRC)评估的PFS获益相差较大,研究给出的解释是BIRC数据估计值受信息审查的影响(与研究者事件不一致:abemaciclib治疗组 51%,安慰剂治疗组 38%)。
综上所示,对于CDK4/6i治疗失败患者,阿贝西利跨线再挑战或可作为一种选择,其中一线使用帕博西利者获益相对明显。对于CDK4/6i经治且伴有PIK3CA/AKT1/PTEN突变人群,靶向AKT信号通路的Capivasertib可带来明显获益。
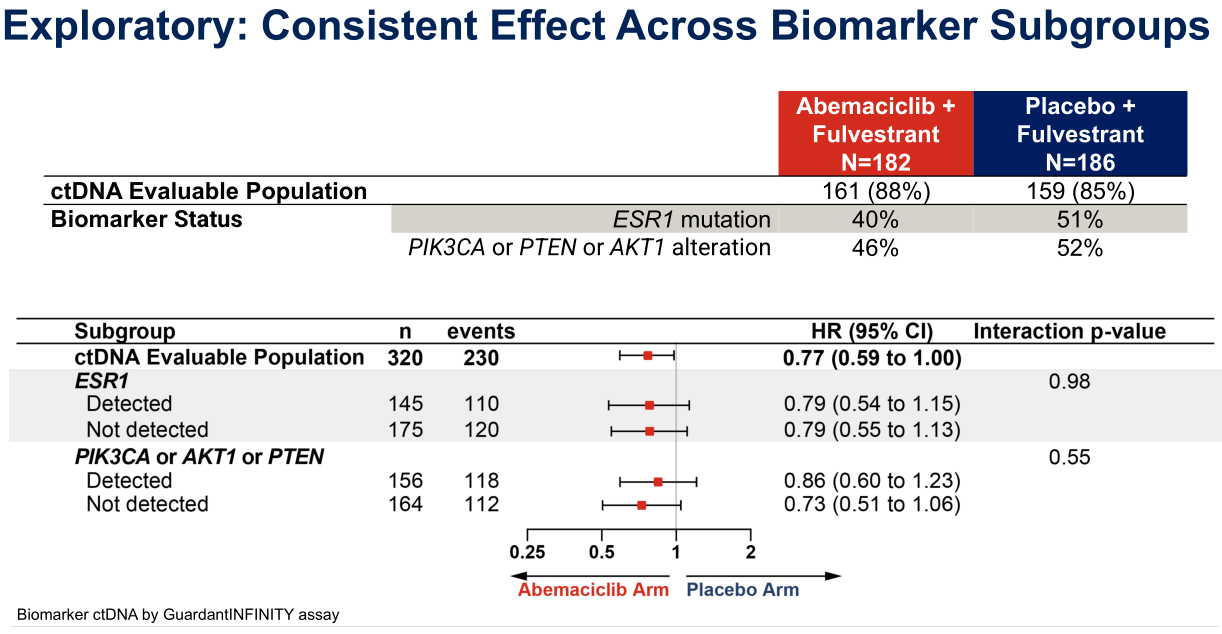
图3 postMONARCH研究探索性分析结果
在抗体偶联药物(ADC)领域,既往德曲妥珠单抗 (T-DXd)的DESTINY-Breast04研究[8]、 DESTINY-Breast06研究[9]和戈沙妥珠单抗
(T-DXd)的DESTINY-Breast04研究[8]、 DESTINY-Breast06研究[9]和戈沙妥珠单抗 (SG)的TROPICS-02研究[10],以及Dato-DXd的TROPION-Breast01研究[11]同样纳入了CDK4/6i治疗失败后HR+/HER2-晚期乳腺癌患者,并取得了积极结果。尤其本次ASCO大会公布的LBA DESTINY-Breast06研究[9]数据给临床带来了更多信心。研究显示,对于既往经至少1线(CDK4/6i联合内分泌治疗6个月内进展或辅助内分泌治疗24个月内进展)或2线内分泌治疗的HR+/HER2-乳腺癌患者,T-DXd对比标准化疗可带来显著获益(PFS:13.2个月 vs 8.1个月;HR=0.63)。因此,当HR+/HER2-乳腺癌患者内分泌治疗进展后,T-DXd不失为一种不错的选择。
(SG)的TROPICS-02研究[10],以及Dato-DXd的TROPION-Breast01研究[11]同样纳入了CDK4/6i治疗失败后HR+/HER2-晚期乳腺癌患者,并取得了积极结果。尤其本次ASCO大会公布的LBA DESTINY-Breast06研究[9]数据给临床带来了更多信心。研究显示,对于既往经至少1线(CDK4/6i联合内分泌治疗6个月内进展或辅助内分泌治疗24个月内进展)或2线内分泌治疗的HR+/HER2-乳腺癌患者,T-DXd对比标准化疗可带来显著获益(PFS:13.2个月 vs 8.1个月;HR=0.63)。因此,当HR+/HER2-乳腺癌患者内分泌治疗进展后,T-DXd不失为一种不错的选择。
精准化、个体化选择,
是CDK4/6i耐药后HR+/HER2-晚期乳腺癌治疗的关键
尽管目前对于CDK4/6i治疗进展后HR+/HER2-晚期乳腺癌的治疗方案,没有标准、统一的答案。但从上述分析中,我们可以发现,精准和个性化治疗选择对于克服CDK4/6i耐药性,提高HR+/HER2-晚期乳腺癌患者的疗效至关重要。
对于PAM信号通路异常的患者,基于现有临床数据 PAM抑制剂可能是更优的选择,因为它们可以直接靶向异常的PAM信号通路,增强CDK4/6i的效果,从而帮助患者从耐药状态中恢复。基于CAPItello-291研究,2024年3月14日,ASCO在线发表的HR+/HER2-晚期乳腺癌内分泌和靶向治疗推荐意见,将Capivasertib+氟维司群作为晚期≥2线携带PIK3CA/AKT1/PTEN突变乳腺癌患者的治疗策略。不仅如此,今年ESMO BC更新的CAPItello-291研究[12]显示,Capivasertib可进一步延长第二次无进展生存期(PFS2,14.7个月 vs 12.5个月,HR=0.70)和首次后续化疗时间(TFSC,11个月 vs 6.8个月,HR=0.63,95%CI 0.52-0.75)。这意味着,Capivasertib可以使CDK4/6i耐药患者在更长时间内维持疾病稳定状态,延迟疾病进展,并推迟化疗的开始时间,让患者有更多的时间恢复身体机能,一定程度上减少长期治疗过程中副作用的累积,从而保障患者的生活质量。
对于PAM信号通路没有异常的患者,在既往 CDK4/6i 治疗进展后进行CDK4/6i再挑战可能是部分患者的选择。基于postMONARCH研究可以看到,一线帕博西利进展后患者从二线阿贝西利治疗中的获益较大。然而,鉴于目前相关研究结果并不一致,不同CDK4/6i在再挑战治疗中的疗效可能存在差异,这需要基于患者的具体情况,如前线治疗特征、CDK4/6i治疗史等因素进行个体化评估。
此外,对于PAM信号通路没有异常且CDK4/6i耐药后不再适合内分泌治疗的患者,T-DXd、Dato-DXd、戈沙妥珠单抗等ADC药物是一种可选的治疗方案。
综上所述,针对CDK4/6i耐药的HR+/HER2-晚期乳腺癌患者,治疗策略应根据患者的基因突变状态、前线的治疗药物和治疗反应以及肿瘤的具体特征进行个性化定制。未来的研究需要进一步明确不同治疗策略的适应症,以及如何最优化地将这些策略应用于临床实践。

