
医脉洞见丨杨谨教授:剑指CDK4/6抑制剂ESR1突变耐药,III期EMERALD试验最新探索性亚组分析结果公布
Elacestrant是一种口服选择性雌激素 受体降解剂(SERD),在随机III期EMERALD试验的主要结果分析中,相较于标准内分泌单药治疗(SOC),Elacestrant展现了更优的疗效。根据患者特征,如既往接受内分泌治疗(ET)联合CDK4/6抑制剂(CDK4/6i)的持续时间、转移部位,以及与雌激素受体1基因(ESR1)突变或其他分子表达的共存情况进行进一步的疗效分析,有助于识别对既往ET产生耐药性但仍对内分泌治疗敏感的肿瘤患者,从而为临床治疗决策提供参考支持。
受体降解剂(SERD),在随机III期EMERALD试验的主要结果分析中,相较于标准内分泌单药治疗(SOC),Elacestrant展现了更优的疗效。根据患者特征,如既往接受内分泌治疗(ET)联合CDK4/6抑制剂(CDK4/6i)的持续时间、转移部位,以及与雌激素受体1基因(ESR1)突变或其他分子表达的共存情况进行进一步的疗效分析,有助于识别对既往ET产生耐药性但仍对内分泌治疗敏感的肿瘤患者,从而为临床治疗决策提供参考支持。
近期,EMERALD研究的探索性亚组分析结果发表在Clinical Cancer Research期刊上。该分析涵盖了接受过ET+CDK4/6i治疗的不同时长、临床或分子标志物不同状态的患者亚组。数据显示,在既往接受ET+CDK4/6i治疗持续时间≥12个月的转移性乳腺癌 患者中,Elacestrant相较于SOC显著延长了其无进展生存期(PFS),且在雌激素受体阳性(ER+)/人表皮生长因子受体2阴性(HER2-)且携带ESR1突变的患者各亚组中表现出一致性。
患者中,Elacestrant相较于SOC显著延长了其无进展生存期(PFS),且在雌激素受体阳性(ER+)/人表皮生长因子受体2阴性(HER2-)且携带ESR1突变的患者各亚组中表现出一致性。
借此契机,医脉通特邀西安交通大学第一附属医院杨谨教授领读文献内容,与您共享。
研究背景
ET+CDK4/6i是ER+/HER2+转移性乳腺癌的一线SOC,而这一方案相关的内分泌耐药长期以来都是困扰医生与科研人员的临床难题。研究表明,其耐药模式包括PI3K/AKT/mTOR通路的原发或获得性耐药以及ESR1基因改变。其中,近50%内分泌耐药的ER+/HER2+转移性乳腺癌患者可观察到ESR1突变,特别是在以芳香化酶抑制剂(AI)作为一线ET后转移的群体中。
在EMERALD试验的主要终点分析中,与SOC相比,Elacestrant显著延长了伴ESR1突变的ER+/HER2-转移性乳腺癌患者的无进展生存期(PFS)。本次亚组分析旨在评估既往ET+CDK4/6i治疗持续时间≥12个月的ESR1突变肿瘤患者中Elacestrant相较于SOC的疗效和安全性。
研究方法
EMERALD是一项国际、多中心、随机、开放标签的III期临床试验,旨在评价Elacestrant相较于标准内分泌治疗(氟维司群 ,阿那曲唑
,阿那曲唑 ,来曲唑
,来曲唑 或依西美坦
或依西美坦 等)在ER+/HER2-晚期/转移性乳腺癌患者的疗效及安全性。纳入既往接受≥2线治疗(包括1-2线晚期ET治疗方案,至少有一线为CDK4/6i联合氟维司群或AI)的ER+/HER2-晚期或转移性乳腺癌成年患者(女性患者须为绝经后)。可纳入在晚期或转移情况下接受过一次化疗的患者。
等)在ER+/HER2-晚期/转移性乳腺癌患者的疗效及安全性。纳入既往接受≥2线治疗(包括1-2线晚期ET治疗方案,至少有一线为CDK4/6i联合氟维司群或AI)的ER+/HER2-晚期或转移性乳腺癌成年患者(女性患者须为绝经后)。可纳入在晚期或转移情况下接受过一次化疗的患者。
患者入组后以1:1随机分配,接受每日一次Elacestrant 345mg或研究者选择的SOC治疗(建议既往未接受过氟维司群治疗的患者选择氟维司群,而氟维司群治疗进展的患者选择AI)。分层因素包括ctDNA检测的ESR1突变状态,既往是否使用氟维司群治疗,是否存在内脏转移等。每8周通过CT或MRI进行肿瘤评估,治疗直至疾病进展。主要研究终点是根据盲法独立审查委员会评估的ESR1突变人群以及全人群的无进展生存期(PFS)。
由于试验设计时未预先进行设定,因此本次分析为探索性终点分析。考虑到在转移性疾病治疗期间较长的ET暴露与ESR1突变的风险增加有关,将根据既往ET+CDK4/6i的持续时间(≥6个月,≥12个月和≥18个月)定义患者亚组。其次,第二组分析在接受Elacestrant和SOC治疗的ESR1突变肿瘤患者中进行评估,该患者群体既往接受ET+CDK4/6i治疗≥12个月,并处于晚期或转移性疾病状态。
研究结果
01、基线特征
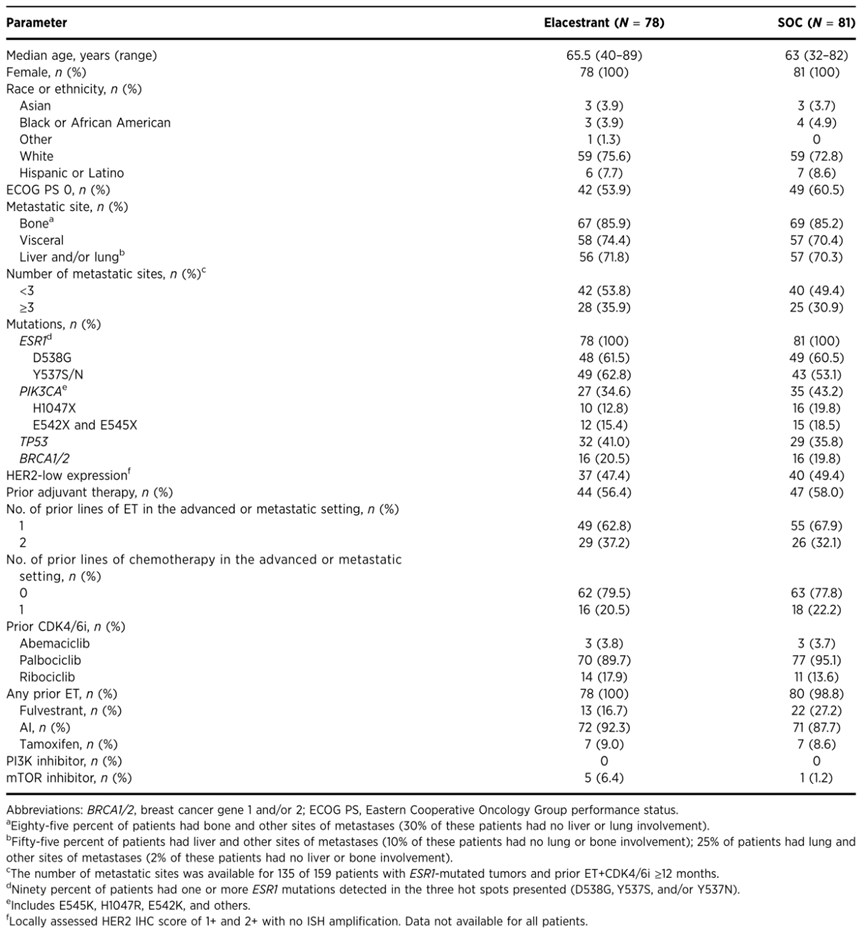
共有478例患者入组(Elacestrant组,239例;SOC组,239例)。其中222例患者(Elacestrant组,112例;SOC组,110例)伴有ESR1突变且晚期或转移环境中接受了ET+CDK4/6i治疗,在该人群中,159例患者(71.6%)既往接受ET+CDK4/6i≥12个月,将其定义为临床病理状态或分子标志物相关亚组分析的总人群,基线特征基本保持平衡。
表1.患者基线特征
02、ET+CDK4/6i持续治疗时间相关亚组的PFS
在伴ESR1突变肿瘤的患者中,与SOC组相比,既往ET+CDK4/6i治疗持续时间较长与Elacestrant的PFS临床意义的改善相关。在既往ET+CDK4/6治疗≥12个月的患者中,Elacestrant组的中位PFS(mPFS)为8.6个月,而SOC组为1.9个月(HR 0.41;95%CI, 0.26-0.63;P<0.014)。对于既往ET+CDK4/6i治疗≥6个月和≥18个月的患者,均观察到相同的改善趋势。
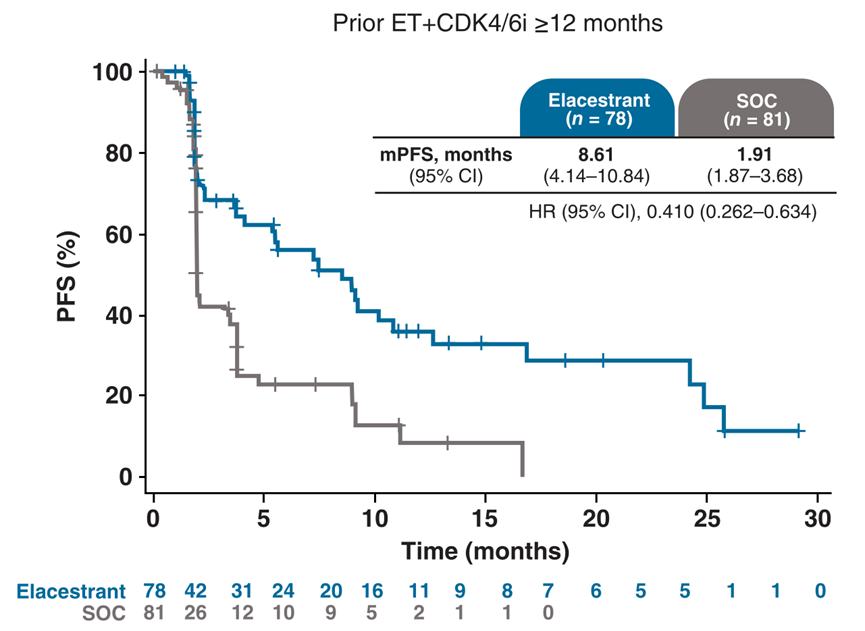
图1. 既往ET+CDK4/6i治疗持续时间≥12个月患者的PFS
03、临床病理状态或分子标志物相关亚组的PFS
在所有评估的亚组中,对于既往接受ET+CDK4/6i治疗≥12个月的ESR1突变肿瘤患者,无论转移部位或数量如何,以及同时伴PIK3CA-mut、TP53-mut或HER2-低表达或ESR1突变的不同变体,与SOC相比,Elacestrant与PFS具有临床意义的改善相关。
表2. 临床或生物标志物相关亚组的PFS分析
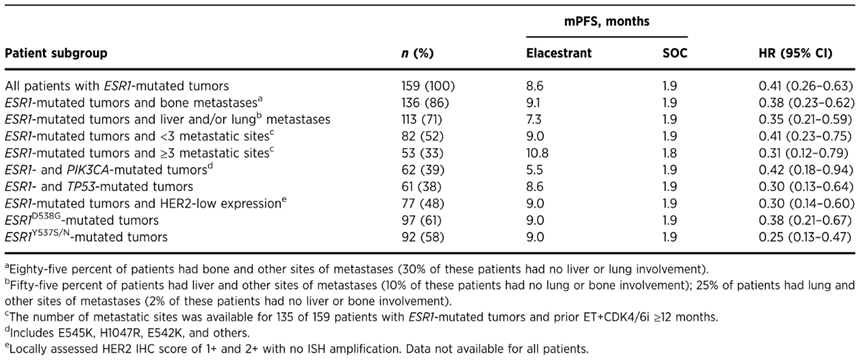
临床病理方面(以下患者均伴ESR1突变),在骨转移患者中,Elacestrant组的mPFS为9.1个月,SOC组为1.9个月(HR 0.38;95% CI, 0.23-0.62);在合并肝和/或肺转移患者中,Elacestrant的mPFS为7.3个月,而SOC为1.9个月(HR 0.35;95% CI, 0.21-0.59);在<3个转移位点患者中,Elacestrant的mPFS为9.0个月,而SOC为1.9个月(HR 0.41;95% CI, 0.23-0.75);在具有≥3个转移位点患者中,Elacestrant组的mPFS为10.8个月,而SOC组为1.8个月(HR 0.31;95% ci, 0.12-0.79)。
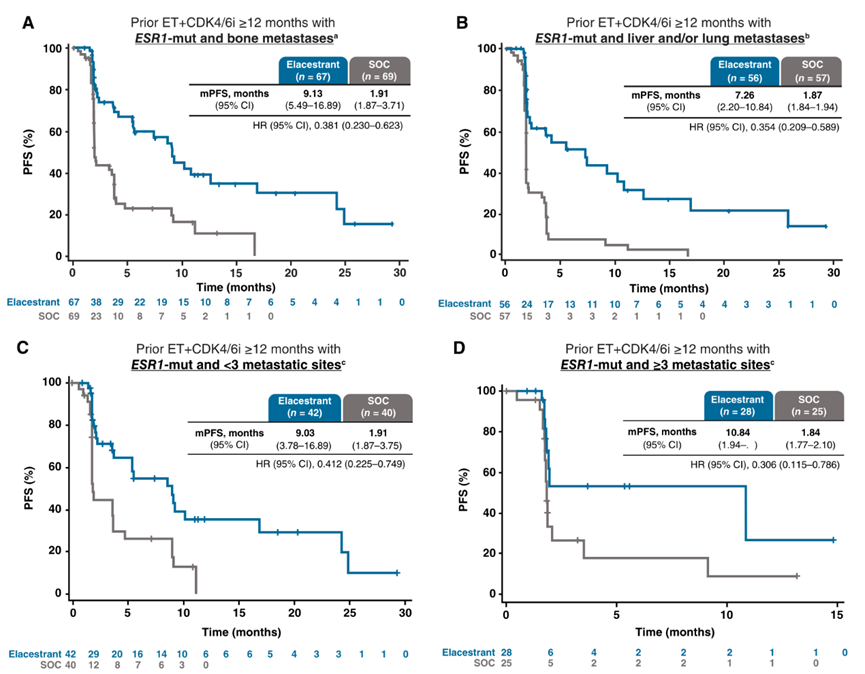
图2. 临床病理状态相关亚组的PFS分析
分子标志物方面(以下患者均伴ESR1突变)的PFS对比如下(mPFS,Elacestrant组 vs SOC组,单位:月[m]):PIK3CA-mut(5.5m vs 1.9m;HR 0.42;95%CI, 0.18-0.94);TP53突变(8.6m vs 1.9个月;HR 0.30;95%CI,0.13-0.64)。HER2低表达(9.0m vs 1.9个m;HR 0.30;95%CI,0.14-0.60)。ESR1D538G突变(9.0m vs 1.9m;HR 0.38;95% CI, 0.21-0.67)。ESR1Y537S/N突变(9.0m vs 1.9m;HR 0.25;95%CI,0.13-0.47)。Elacestrant与以下变量之间相互作用的P值表明,这些共存突变或分子表达的存在并不影响Elacestrant与SOC之间的疗效对比:PIK3CA-mut (P = 0.13)、TP53-mut (P = 0.47)和HER2低表达(P = 0.32)。此外,在分析PIK3CA-mut位点和BRCA1/2突变时,Elacestrant也有类似的益处。
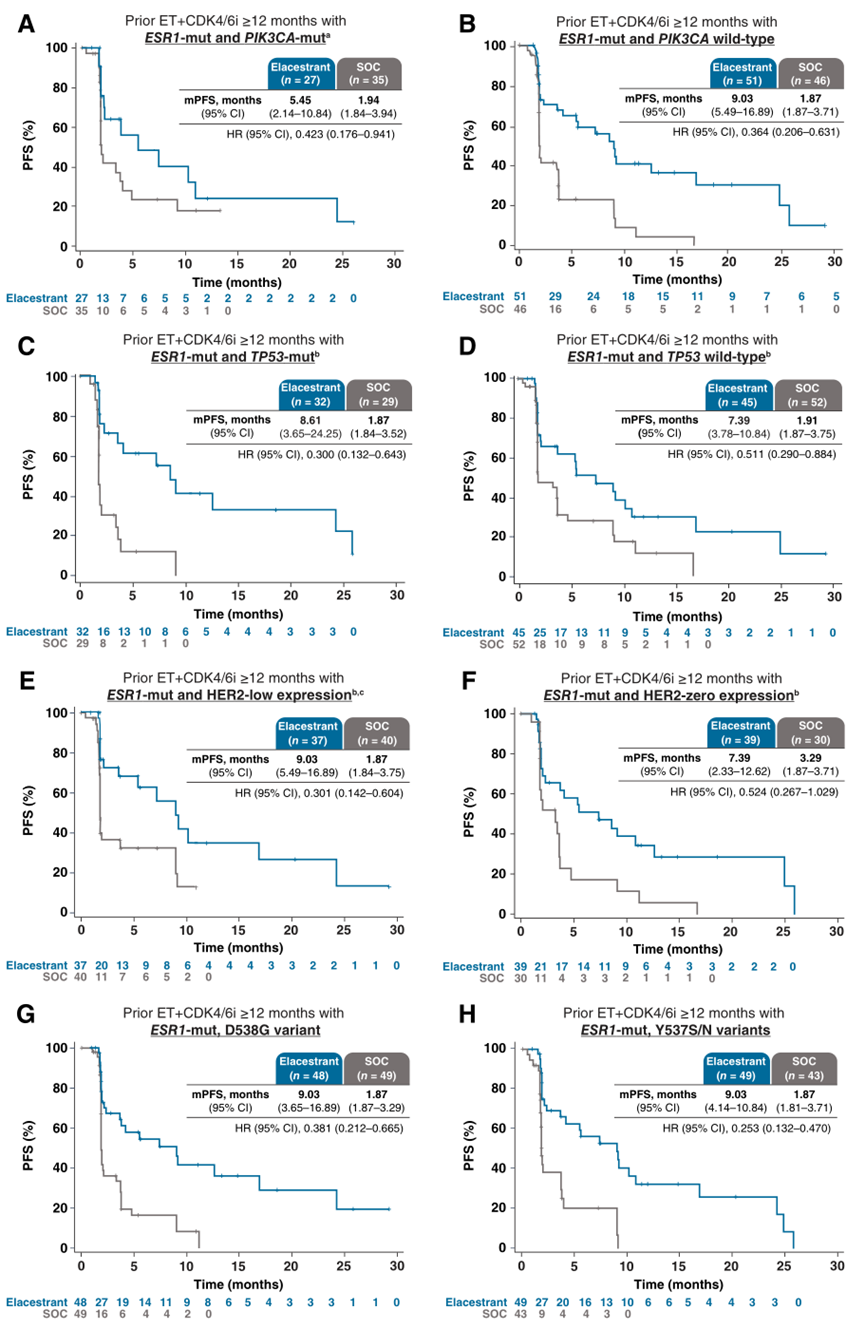
图3. 分子标志物相关亚组的PFS分析
04、安全性
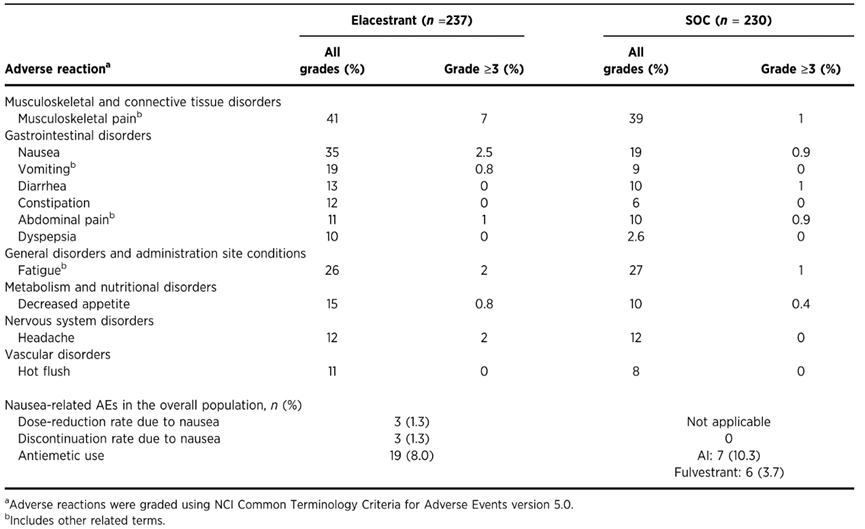
在总人群中大多数不良事件(AE)为1-2级,因任何与治疗相关的AE而中断治疗的患者共有10例(Elacestrant组8例,SOC组2例)。两组均未报告与治疗相关的死亡,未观察到血液学安全信号,未报告窦性心动过缓事件。
表3列出了最常见AE的最新安全性分析以及恶心和止吐药使用的信息。观察到的最常见的全级别胃肠道AE包括恶心(Elacestrant组35% vs SOC组19%)和呕吐(Elacestrant组19% vs SOC组9%)。未报告4级恶心或呕吐。Elacestrant减量比例和因恶心而停药率均为1.3%。8%的Elacestrant治疗患者需要使用止吐药,Ais治疗患者为10.3%,氟维司群治疗患者为3.7%。ESR1突变肿瘤患者的既往ET+CDK4/6i持续时间或临床和生物标志物亚组的安全性数据与总人群一致。
表3. 安全性数据
研究结论
在既往接受ET+CDK4/6i治疗持续时间≥12个月的转移性乳腺癌患者中,Elacestrant相较于SOC显示出显著的PFS改善。这一疗效在ER+/HER2-且携带ESR1突变的肿瘤患者的各个亚组中表现一致,且安全性良好。


