
菲常血液丨李菲教授解析CAR-T细胞疗法相关血液学毒性的管理策略
医脉通编辑整理,未经授权请勿转载。
嵌合抗原受体(CAR)T细胞疗法在复发/难治性血液恶性肿瘤治疗中展现出显著疗效,过去大家往往更为关注的是细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)的机制和处理。随着CAR-T疗法的广泛运用,其伴随的血液学毒性(HTs)也越来越受到大家所重视,HTs往往是导致患者治疗失败和影响患者生存质量的主要因素。南昌大学第一附属医院李菲教授及团队对CAR-T细胞疗法后HTs的机制、临床表现及管理策略进行系统综述,文章发表于《Experimental Hematology & Oncology》,旨在为临床实践提供指导。
血细胞减少
CAR-T细胞输注后的细胞减少症根据其发作和持续时间分为三组:早期血细胞减少症(0-30天)、持续性血细胞减少症(30-90天)和晚期血细胞减少症(90天后)[1]。近期欧洲血液学协会(EHA)和欧洲血液和骨髓移植学会(EBMT)将其命名为免疫效应细胞相关血液学毒性(ICAHT),并分为早期(0-30天)和晚期(>30天)[2]。ICAHT发生率高,导致输血 依赖、感染和出血风险增加。其中,感染相关死亡是CAR-T治疗后非复发死亡的主要原因[3]。
依赖、感染和出血风险增加。其中,感染相关死亡是CAR-T治疗后非复发死亡的主要原因[3]。
01危险因素
CAR-T细胞治疗相关血细胞减少症危险因素诸多,包括患者基线特征、重度CRS、预处理方案、CAR-T细胞结构等[4-7]。
02发病机制
ICAHT发病机制尚不明确,目前认为主要与以下因素相关:①慢性炎症介导的造血抑制:CAR-T细胞激活后释放IL-6、IFN-γ等炎症因子,抑制HSC增殖并破坏骨髓微环境(BMM)[8];②HSC及骨髓微环境损伤:基质细胞分泌的CXCL12和SCF减少,ROS累积导致HSC功能耗竭[8,9];③克隆性造血与继发恶性肿瘤:CHIP(如DNMT3A、TP53突变)患者更易进展为MDS[10]。(图1)

图1
03管理策略
早期血细胞减少症
CAR-T细胞治疗后血细胞减少的发生率非常高。患者通常在输注后最初30天内出现不同程度的血细胞减少症,其中3至4级中性粒细胞减少症最常见。血细胞减少至临界值时(Hb<7g/dL或PLT<10×10⁹/L)应积极进行成分血输注支持治疗以改善贫血 并预防致死性出血。当ANC<500/μL时,使用粒细胞集落刺激因子
并预防致死性出血。当ANC<500/μL时,使用粒细胞集落刺激因子 (G-CSF)刺激造血[11]。研究发现,早期使用(CAR-T输注后第2天)G-CSF可降低发热
(G-CSF)刺激造血[11]。研究发现,早期使用(CAR-T输注后第2天)G-CSF可降低发热 性中性粒细胞减少风险。预防病毒感染应在CAR-T治疗后立即启动并持续6至12个月,抗肺孢子虫肺炎(PJP)预防通常在第30天开始[1]。2023年EBMT和EHA共识建议对CAR T细胞治疗患者进行抗PJP和抗病毒预防,一旦ANC<500/µL,被视为严重(≥3级)ICAHT高风险患者,应立即进行预防及抗菌治疗。
性中性粒细胞减少风险。预防病毒感染应在CAR-T治疗后立即启动并持续6至12个月,抗肺孢子虫肺炎(PJP)预防通常在第30天开始[1]。2023年EBMT和EHA共识建议对CAR T细胞治疗患者进行抗PJP和抗病毒预防,一旦ANC<500/µL,被视为严重(≥3级)ICAHT高风险患者,应立即进行预防及抗菌治疗。
持续性或晚期血细胞减少症
对于晚期血细胞减少患者,需先排除原发病进展/复发或第二肿瘤等病理因素。排外其它病理因素后便可同样进行积极促造血治疗,当ANC<500/µL时使用可使用G-CSF刺激造血。同时,根据患者血液细胞减少症个体风险特征采取抗感染预防措施,以降低感染风险。CAR-T细胞治疗后出现严重贫血或血小板减少的患者需给予成分输血,以避免致命出血。血小板生成素受体激动剂(TPO-RA)已成为治疗长期血小板减少症的有希望的疗法。此外,抗细胞因子疗法(例如阿那白滞素和托珠单抗 )已在某些中心用于治疗长期血细胞减少症患者,但疗效不明确。
)已在某些中心用于治疗长期血细胞减少症患者,但疗效不明确。
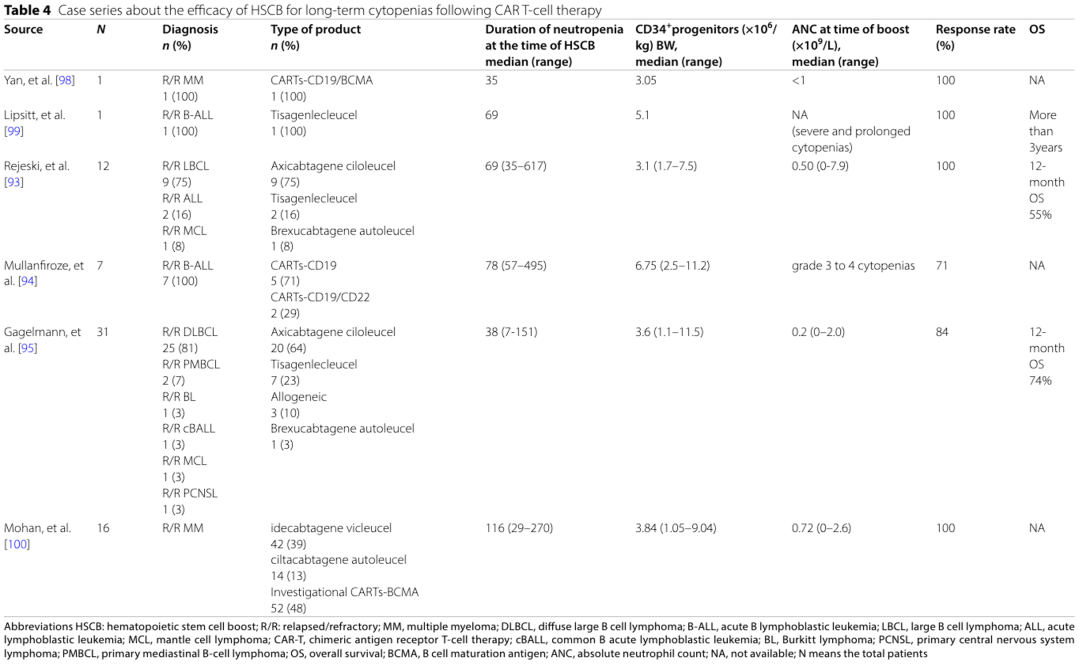
对于G-CSF治疗无效的患者,可进行HSC增强(boost)治疗,输注自体/同种异基因CD34+干细胞细胞[12,13]。小样本病例报道显示HSC增强对CAR-T治疗后严重、长期血细胞减少疗效较好,可实现中性粒细胞和血小板持续植入。专家建议CAR-T输注后+14天出现3级及以上ICAHT患者及时启动HSCB治疗,HSC增强难治者可考虑allo-HSCT。
对G-CSF难治性和/或无反应的患者,可进行HSC增强(boost)治疗,输注先前采集冷冻保存的自体/同种异基因CD34+干细胞。小样本病例报道显示HSC增强对CAR-T治疗后严重、长期血细胞减少疗效较好,可实现中性粒细胞和血小板持续植入(表1)。专家小组建议,应考虑在CAR-T细胞输注后+14天后发生至少3级ICAHT的患者中进行HSC增强治疗。对于难治性病例可考虑异基因造血干细胞移植(allo-HSCT),但需权衡感染风险与疾病进展。
表1
CAR-T治疗相关噬血细胞性淋巴组织细胞增多症(carHLH)
carHLH也称为免疫效应细胞相关HLH样综合征(IEC-HS),发病率为2.7%-14.8%,是一种危及生命的严重并发症。carHLH表现为巨噬细胞和淋巴细胞活性升高、促炎细胞因子过度分泌、组织渗透、噬血细胞增多和多器官功能障碍。多在CAR-T细胞输注后10-14天发生,少数病例在CRS消退后迟发。
01诊断标准
目前认为,用于诊断噬血细胞性淋巴组织细胞增多症(HLH)的评估体系HLH-2004诊断标准和H评分系统难以用于评估carHLH患者群体。2017年CAR-T细胞疗法相关的毒性(CARTOX)工作组指定的诊断标准为:CRS阶段峰值铁蛋白水平>10,000ng/mL,且满足以下至少两项附加标准:(1)肝脏、肾脏或肺脏发生≥3级器官毒性;(2)骨髓或其他器官组织病理学检测发现噬血现象,即可诊断carHLH。但临床上严重CRS与carHLH/MAS仍难以鉴别。近期美国移植与细胞治疗学会(ASTCT)建立了新诊断标准,以区分IEC-HS与严重CRS及ICANS(详见表2)。这些诊断框架通过明确CAR T细胞治疗相关并发症特征,为精准临床干预提供依据。
表2

02危险因素
carHLH危险因素主要包括重度CRS、CRS持续时间、高铁蛋白以及IFN-γ、IL-18、颗粒酶B显著升高等[9,14]。
03发病机制
目前认为carHLH的发病机制可能涉及以下关键环节:
1.CAR-T细胞活化与细胞因子释放
(1)活化的CAR-T细胞(尤其是CD8⁺和CD4⁺亚群)释放大量促炎细胞因子(IFN-γ、TNF-α、IL-6、GM-CSF等),驱动全身性炎症反应。
(2)穿孔素(perforin)缺陷:CAR-T细胞中穿孔素表达缺失导致细胞毒性功能异常。穿孔素缺陷的CAR-T细胞在体内持续扩增,进一步释放GM-CSF、TNF-α、IFN-γ等细胞因子,引发炎症级联反应,最终在CRS缓解后诱发迟发性HLH(图2)。
2.肿瘤细胞焦亡与IL-18/IFN-γ轴激活
carHLH患者(尤其是CD22靶向CAR-T治疗相关病例)中游离IL-18水平显著升高,过量游离IL-18与免疫细胞(T细胞、NK细胞、树突状细胞等)表面的IL-18受体结合,激活NF-κB、STAT3、MAPK及JNK信号通路,诱导IFN-γ爆发性释放,形成恶性炎症循环。(图2)
3.铁蛋白的促炎正反馈作用
carHLH患者血清铁蛋白水平显著升高,激活NF-κB通路促进炎症细胞因子(如IL-1β、IL-6、IL-12、TNF-α)及趋化因子MIP-1α的释放,加剧“细胞因子风暴”。(图2)
carHLH的发病是CAR-T细胞功能异常、肿瘤焦亡相关炎症信号放大及宿主免疫调控失衡共同作用的结果,然而,各通路间的相互作用及主导机制仍需进一步研究,尤其是针对不同CAR靶点(如CD19、CD22)的carHLH是否存在异质性机制仍需深入探索。
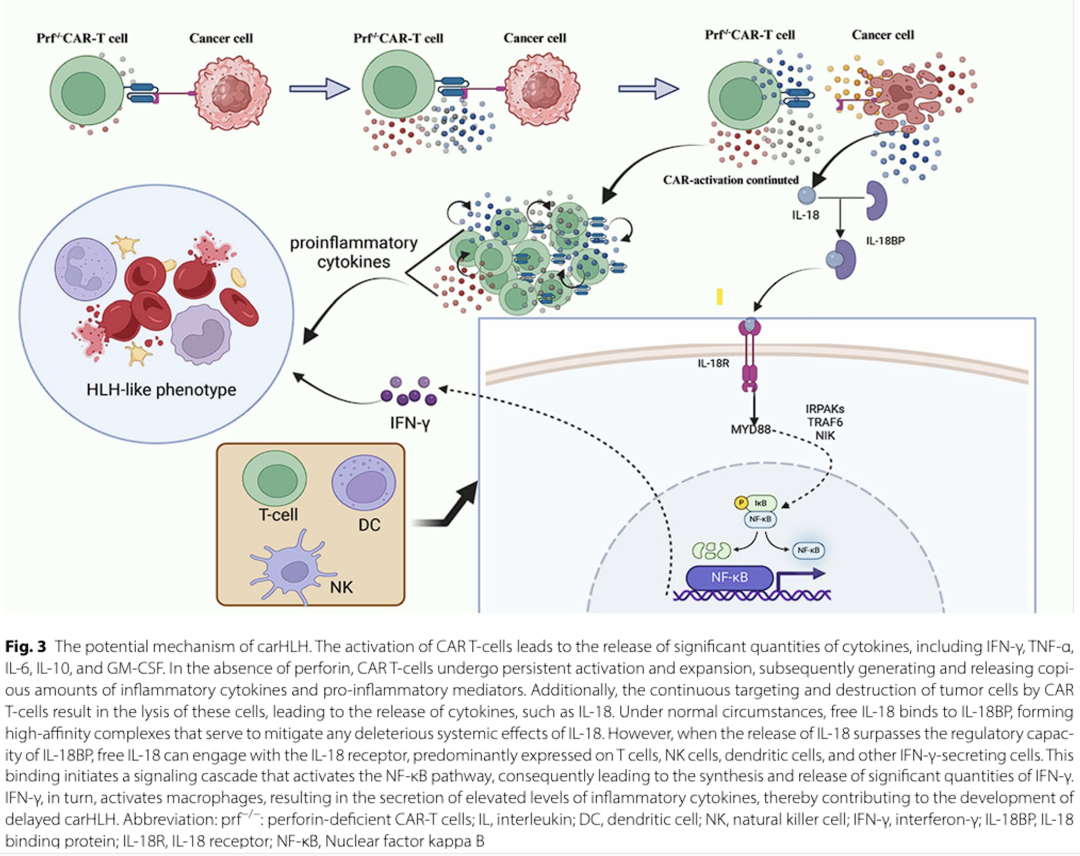
图2
04管理策略
carHLH患者的管理首先应密切检测患者生命征及噬血相关实验室参数(血细胞计数、肝肾功能、铁蛋白及甘油三酯水平),早期识别病情进展及器官功能障碍。对于无严重器官损伤或神经毒性患者,一线治疗推荐使用地塞米松 10mg静脉注射,每6小时1次,难治性病例可增至20mg/次;伴终末器官受累患者建议使用地塞米松冲击治疗(5-10mg/m²,每6-24小时1次)[15]。激素疗效不佳同时合并3级以上器官毒性者NCCN指南推荐联用抗细胞因子治疗(如托珠单抗、阿那白滞素)。激素及抗细胞因子治疗无应答时,可使用细胞毒类药物(依托泊苷
10mg静脉注射,每6小时1次,难治性病例可增至20mg/次;伴终末器官受累患者建议使用地塞米松冲击治疗(5-10mg/m²,每6-24小时1次)[15]。激素疗效不佳同时合并3级以上器官毒性者NCCN指南推荐联用抗细胞因子治疗(如托珠单抗、阿那白滞素)。激素及抗细胞因子治疗无应答时,可使用细胞毒类药物(依托泊苷 )、JAK1/2抑制剂治疗[16,17]。近年来,小部分个案及临床试验显示IFN-γ拮抗剂(如依帕伐单抗)对进展性carHLH患者有效。
)、JAK1/2抑制剂治疗[16,17]。近年来,小部分个案及临床试验显示IFN-γ拮抗剂(如依帕伐单抗)对进展性carHLH患者有效。
carHLH管理以早期识别、分层治疗为核心,激素联合细胞因子靶向治疗为基石,难治病例需个体化选择细胞毒药物或新型靶向药物。未来亟需循证医学证据完善治疗体系。
CAR-T相关凝血功能障碍(CARAC)
嵌合抗原受体相关凝血病(CARAC),是CAR-T细胞治疗中最常见的HTs之一,常于CAR-T细胞输注后28天内发生。19.6%的CARAC患者合并有临床意义的出血事件,其中14%-50%的病例会进展为DIC,DIC患者死亡率达6.7%-42.9%。CARAC危险因素主要包括基线肿瘤负荷高、基线血小板减少、淋巴细胞计数降低、CAR-T细胞迅速扩增、CRS≥3级、ICANS≥3级[18,19]。
01发病机制
迄今为止,多项研究致力于阐明CARAC的病理机制。血小板活化、单核细胞激活、内皮细胞损伤及其介导的CD40/CD40L信号通路共同参与CRS相关凝血障碍的发生[20]。重度CRS患者中,IL-6、TNF-α等细胞因子异常升高可诱导肝功能不全进而影响凝血因子合成,同时激活并损伤内皮细胞,暴露内皮下胶原纤维,进而激活内/外源性凝血途径[21]。此外,CAR-T细胞脱靶效应导致的肝细胞损伤可进一步加剧凝血因子合成障碍。最新蛋白质组学研究发现补体系统激活和急性炎症反应在CARAC发生中起关键作用,但其具体分子机制仍需深入探索[22]。
02管理策略
接受CAR-T细胞治疗的患者常出现凝血指标异常及重度(≥3级)CRS。对于CRS相关凝血障碍合并严重低纤维蛋白原血症患者,当纤维蛋白原水平<1.5g/L时建议启动纤维蛋白原浓缩物替代治疗,并在首次输注后30-60分钟进行快速疗效评估。若PT≥3秒和/或APTT≥10秒可输注新鲜冰冻血浆。同时,糖皮质激素 与托珠单抗作为CRS的核心治疗手段,通过降低IL-6等细胞因子水平,可间接改善凝血功能障碍及DIC[19,23]。
与托珠单抗作为CRS的核心治疗手段,通过降低IL-6等细胞因子水平,可间接改善凝血功能障碍及DIC[19,23]。
B细胞再生障碍
CAR-T细胞治疗特有的毒性反应——靶向/脱瘤效应,源于对正常组织的直接攻击。以CD19/CD22为靶点的CAR-T细胞可导致正常B细胞损伤,引发B细胞再生障碍及低丙种球蛋白血症,显著增加感染风险[24]。危险因素包括造血储备不足、多谱系免疫重建障碍等。对于低丙种球蛋白血症持续时间不足6个月者无需干预;持续性病例(尤其儿童)需启动免疫球蛋白替代治疗;严重/反复感染者优先选择IVIG[25]。
结论
CAR-T细胞治疗相关HTs的临床表现具有非特异性且异质性显著,常致使漏诊、误诊及诊断延迟,进而增加患者接受CAR-T治疗的风险,致使患者生活质量显著降低,住院时长延长,同时加重社会医疗负担。深入探究HTs的发病机制,优化CAR T细胞设计,建立健全高效且安全的诊疗措施以降低HTs相关死亡率,是推动CAR T疗法广泛应用的关键方向。

李菲 教授
南昌大学第一附属医院血液病中心主任医师、教授、博士生/博士后合作导师
江西省血液系统疾病重点实验室主任
江西省血液病临床医学研究中心主任
江西省血液病医疗质控中心主任
南昌大学淋巴肿瘤疾病研究所主任
中华血液学杂志通讯编委,临床血液学杂志、中国临床肿瘤杂志编委
中华医学会血液学分会常务委员
中华医学会血液学分会淋巴疾病学组委员
国家血液病质控中心专家委员会委员
江西省医学会血液学分会候任主委
中国CSCO骨髓瘤专家委员会副主任委员
中国CSCO抗淋巴瘤联盟委员
中国医药教育协会造血干细胞移植和免疫治疗分会副主任委员
中国抗癌协会血液肿瘤(肿瘤血液)专委会委员
中国慢淋专家组委员
中国噬血细胞综合征 联盟专家组委员
联盟专家组委员
中国女医师协会靶向专委会血小板病副组长

杨园园 博士
南昌大学医学部第一临床医学院2024级博士研究生(导师:李菲教授)
以第一作者/共同第一作者身份于Experimental Hematology & Oncology,Therapeutic Advances in Hematology等期刊发表SCI论文4篇,北大核心论文2篇

