
肺凡案例 | 余慧青教授:一例⁶⁸Ga-DOTATATE PET/CT诊断肺神经内分泌肿瘤伴巨大肝转移、多发骨转移病例
作者:余慧青 重庆大学附属肿瘤医院
本文为作者授权医脉通发布,未经授权请勿转载
神经内分泌肿瘤(NENs)是一类起源于肽能神经元和神经内分泌细胞的肿瘤,好发于胃肠道、胰腺和肺部,通常生长抑素 受体(SSTR)表达明显升高。近年来,随着早期诊断和治疗的改善,NENs患者的生存期延长,其发病率和患病率均有所增加。基于SSTR的68Ga-DOTATATE(DOTA-DPhe1-Tyr3-octreotate)正电子发射计算机断层显像
受体(SSTR)表达明显升高。近年来,随着早期诊断和治疗的改善,NENs患者的生存期延长,其发病率和患病率均有所增加。基于SSTR的68Ga-DOTATATE(DOTA-DPhe1-Tyr3-octreotate)正电子发射计算机断层显像 (PET/CT)在NENs的诊断、分期和评估方面优于传统PET/CT成像技术。
(PET/CT)在NENs的诊断、分期和评估方面优于传统PET/CT成像技术。
重庆大学附属肿瘤医院余慧青教授分享并点评了一例68Ga-DOTATATE PET/CT诊断肺NENs伴巨大肝转移、多发骨转移的病例,旨在提高临床医生对NENs的认知,从而促进疾病的早诊早治。
患者基本信息
患者男性,64岁。
主诉:咳嗽 1年余,伴腰背部疼痛1周。
1年余,伴腰背部疼痛1周。
现病史:2021年12月前患者无明显诱因出现咳嗽,少痰,不伴发热 、咯血
、咯血 、腹痛、腹泻
、腹痛、腹泻 、心慌、头痛
、心慌、头痛 不适,于当地医院就诊,口服药物后缓解(具体不详)。2022年12月因“咳嗽1年余,伴腰背部疼痛1周”就诊于外院,胸腰椎CT检查
不适,于当地医院就诊,口服药物后缓解(具体不详)。2022年12月因“咳嗽1年余,伴腰背部疼痛1周”就诊于外院,胸腰椎CT检查 提示肝右巨大不规则低密度团块,多发不规则低密度结节,考转移性恶性肿瘤可能性大;右肺中叶不规则分叶结节,不排除转移瘤可能;胸椎多个低密度结节,不排除转移瘤可能。患者咳嗽时伴有腰背部疼痛,可自行缓解,但影响夜间睡眠,为进一步诊治就诊于我科。
提示肝右巨大不规则低密度团块,多发不规则低密度结节,考转移性恶性肿瘤可能性大;右肺中叶不规则分叶结节,不排除转移瘤可能;胸椎多个低密度结节,不排除转移瘤可能。患者咳嗽时伴有腰背部疼痛,可自行缓解,但影响夜间睡眠,为进一步诊治就诊于我科。
烟酒史:饮酒史30年,每次100ml,吸烟史30年,约每日10支,现未戒烟、未戒酒。
既往史、家族史:无特殊。
入院诊疗过程
检查
1)体格检查
KPS 80分,NRS 0分。神清,对答切题。慢性病容,全身浅表淋巴结未扪及肿大,右肺呼吸音稍低,未闻及干湿性啰音。心律齐,腹部软,无压痛反跳痛。双下肢无水肿 。
。
2)实验室检查
肝功能:谷丙转氨酶、谷草转氨酶正常,γ谷氨酰转肽酶 110.20U/L↑、乳酸脱氢酶 300.30U/L↑、α羟丁酸脱氢酶225.90U/L↑。
血电解质:钾3.43mmol/L↓、镁1.07mmol/L↑,余正常;肝纤维化 谱测定:Ⅳ型胶原52.50ng/ml↑、III型前胶原45.20ng/ml↑,余正常。
谱测定:Ⅳ型胶原52.50ng/ml↑、III型前胶原45.20ng/ml↑,余正常。
乙肝DNA测定(PCR荧光定量法):乙肝病毒DNA<1.00E+02IU/ml。
肿瘤标志物检测 :糖抗原CA153 53.60U/ml↑、神经元特异性烯醇化酶53.20ng/ml↑,AFP、CEA、CA125、CYFRA211、SCC均阴性。
:糖抗原CA153 53.60U/ml↑、神经元特异性烯醇化酶53.20ng/ml↑,AFP、CEA、CA125、CYFRA211、SCC均阴性。
三大常规、肾功能、心肌酶谱、血糖、血气分析无明显异常。
3)18FDG-PET/CT(2023/1/7)
右肺中叶外侧段见分叶结节影,直径约1.4cm,SUVmax约2.2,病灶邻近支气管内见条状密度增高影,SUVmax值约3.3;肝内多发肿块,代谢增高,较大者位于肝右叶,最大横截面约9.4cm×10.0cm,其内伴多发坏死,边缘多发结节状代谢增高,SUVmax约10.5;L4、5椎体代谢增高影,SUVmax约4.4,考虑为骨转移可能,余脊柱代谢不均,转移不除外(图1)。
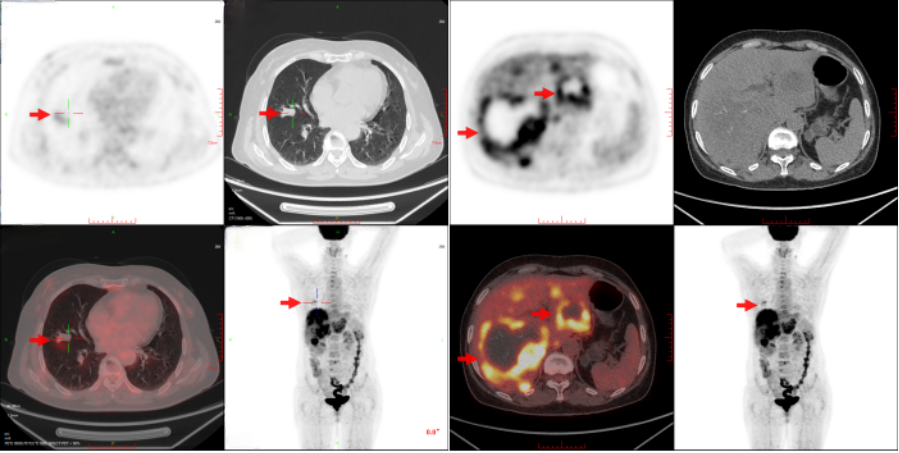
图1 患者18F-FDG PET/CT图像
4)超声引导下肝脏穿刺活检病理检查 (2023/1/13):
(2023/1/13):
(K23-00309)(肝右叶肿物)肿瘤性病变,免疫组化表型符合神经内分泌肿瘤。 免疫组化结果:CK8/18(+),AFP(-),Hepatocyte(-),CK19(-),CEA(-),Arginase-1(-),Glypican-3(-),CD34(-),P53(散在+),CK-pan(+),Syn(+),CgA(+),CD56(+),Ki-67(+热点区域20%)。
5)68Ga-DOTATATE(2023/1/16)
右肺中叶外侧段见一不规则软组织结节影,大小约1.5cm×1.3cm,边缘可见短毛刺影,SUVmax值为2.2,周围见模糊斑片影,邻近偏上方肺内另见一软组织结节影,大小约2.0cm×1.3cm,SUVmax值为3.0,符合神经内分泌肿瘤表现;肝内多发稍低密度肿块影、结节影,较大病灶位于右叶,大小约10.3cm×8.5cm,其内见稍高密度斑片影,显像剂分布不均;颅底骨、多发椎体及附件、双侧肩胛骨、右侧第4肋、右侧第8肋、右侧髂骨、左侧髋臼可见骨质破坏影,显像剂浓聚,SUVmax值为5.0(图2)。
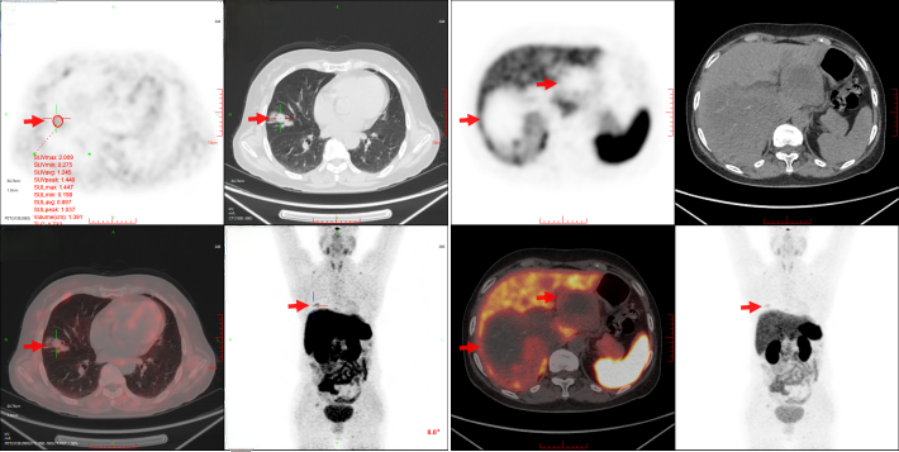
图2 患者68Ga-DOTATATE PET/CT图像
6)上腹部增强CT检查(2023/03/09)
右肺中叶实性结节,较前变化不大;左肺多个结节,部分较前新发,余较前变化不大;肝内多发结节及肿块,部分较前增大,考虑肝恶性肿瘤,肝左叶实质及病变内增碘油沉积,较前减少(图3)。
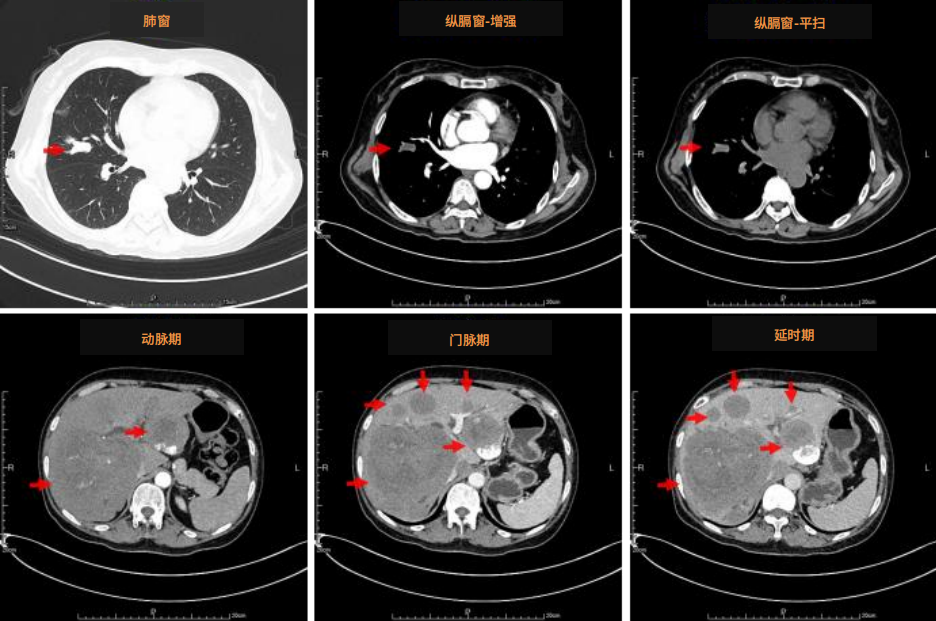
图3 患者上腹部增强CT图像
诊断与鉴别诊断
根据患者的影像学检查、病理结果,肺部神经内分泌肿瘤伴肝脏、骨转移诊断明确。
治疗
根据CSCO神经内分泌肿瘤诊疗指南(2022年版),对于外科手术无法达到根治的患者,建议系统性全身治疗,从而抑制肿瘤增殖、控制激素相关症状。同时,可结合手术、TAE 或射频消融术等局部治疗以降低肿瘤负荷。可用于全身治疗的药物有生长抑素类似物(如奥曲肽 、兰瑞肽
、兰瑞肽 )、分子靶向药物(如索凡替尼
)、分子靶向药物(如索凡替尼 、依维莫司
、依维莫司 )、肽受体介导的放射性核素治疗(PRRT)、细胞毒性化疗、免疫治疗(尚处于临床探索阶段)等。经肿瘤多学科协作(MDT)讨论后建议全身靶向药物联合局部介入抗肿瘤治疗,患者自行口服索凡替尼靶向抗肿瘤治疗,偶有腰背部疼痛不适,可耐受;2023年1月31日行第一次肝动脉化疗栓塞术+肝动脉置管化疗术,术后恢复可。2023年3月9日复查上腹部增强CT示肝内多发结节及肿块,部分较前增大,排除禁忌后于2023年3月15日再次行肝动脉化疗栓塞术,手术顺利,术后予以保肝、补液、护胃等对症支持治疗。
)、肽受体介导的放射性核素治疗(PRRT)、细胞毒性化疗、免疫治疗(尚处于临床探索阶段)等。经肿瘤多学科协作(MDT)讨论后建议全身靶向药物联合局部介入抗肿瘤治疗,患者自行口服索凡替尼靶向抗肿瘤治疗,偶有腰背部疼痛不适,可耐受;2023年1月31日行第一次肝动脉化疗栓塞术+肝动脉置管化疗术,术后恢复可。2023年3月9日复查上腹部增强CT示肝内多发结节及肿块,部分较前增大,排除禁忌后于2023年3月15日再次行肝动脉化疗栓塞术,手术顺利,术后予以保肝、补液、护胃等对症支持治疗。
治疗结果、随访及转归
2 个疗程后复查CT:肝内多发结节及肿块,部分较前增大,考虑肝恶性肿瘤,肝左叶实质及病变内增碘油沉积,较前减少;右肺中叶实性结节,性质待定,较前变化不大。根据RECIST 1.1疗效评估:疾病稳定(SD)。
讨论
肺NENs为高度异质性肿瘤,约占肺部原发恶性肿瘤的25%,好发于有吸烟史的老年男性,临床可表现为咳嗽、咯血,症状和体征缺乏特异性[1, 2]。支气管肺NENs的类型包括典型/非典型类癌、小细胞癌、大细胞NENs和弥漫性特发性肺神经内分泌细胞增生[3]。根据细胞增殖核抗原Ki-67指数,将肺NENs分为3级[4]:G1级,Ki-67<4%,无坏死;G2级,4%≤Ki-67≤25%,坏死区域见于<10个高倍视野(HPF);G3级,Ki-67>25%,坏死区域见于>10个HPF。
本例患者经肝脏穿刺病理活检明确了神经内分泌瘤(G2)的诊断。2020年欧洲肿瘤内科学会(ESMO)指南指出:对于所有G2级以上NENs患者,同时进行18FDG-PET/CT和68Ga-PET/CT检查能帮助获得最佳的诊断和更多的预后相关信息。从本例患者显像结果来看,68Ga-PET/CT对NENs患者的临床分期、恶性程度和后续治疗等具有重要的指导意义。由于大约20%的NENs不表达能被68Ga-PET/CT识别的SSTR,因此联合应用18FDG-PET/CT检查对于对于NENs的诊断和分期仍十分必要。68Ga-PET/CT这种特异性的显像方法可以筛选出有机会接受生长抑素类似物及肽受体放射性核素治疗(PRRT)治疗的患者[5, 6],在一定程度上改变NENs的诊断策略,为NENs的早发现、早诊断、早治疗提供技术支撑。
治疗方面,80%以上的肺NENs确诊时为I期或II期,IV期患者最常见的转移部位为肝、骨和肺[7]。对于晚期肺NENs的治疗目标包括功能性NENs的症状控制和抑制肿瘤生长,以改善患者生活质量、延长生存期。其中全身抗肿瘤增殖治疗方法包括生长抑素类似物(如奥曲肽、兰瑞肽)、分子靶向药物(如依维莫司、索凡替尼)、化疗、PRRT等。索凡替尼是靶向血管内皮细胞生长因子受体(VEGFR1/2/3),成纤维细胞生长因子受体(FGFR1)和集落刺激因子1受体的小分子多激酶抑制剂。III期临床研究SANET-ep中包括23例肺NENs患者,与安慰剂对比,索凡替尼组PFS延长5.4个月(研究者评估PFS为9.2个月),客观缓解率也明显高于安慰剂组(分别为10%和0%)[8]。基于此,索凡替尼被推荐用于疾病进展的晚期肺NENs的治疗。
总之,肺NENs伴肝、骨转移的诊治需要兼顾全身控制与局部症状管理,结合病理分级、转移灶特征及患者状态制定分层策略。早期干预骨转移并发症(如脊髓压迫)及合理使用骨保护剂可显著改善生活质量。MDT是优化预后的关键。


