
临研献策 | 任胜祥/吴凤英教授团队揭示中央型与周围型ES-SCLC的治疗应答差异
小细胞肺癌 (SCLC)占肺癌的10%-15%,其恶性程度高、进展迅速,尤其是ES-SCLC的预后更差,亟需探索有效的治疗策略。近期,同济大学附属上海市肺科医院任胜祥、吴凤英教授团队和中国科学院上海生物化学与细胞生物学研究所陈洛南教授团队在MedComm上发表了一项揭示MYC-Notch轴表达差异是广泛期小细胞肺癌(ES-SCLC)异质性及差异性治疗应答基础的研究。为深入了解研究的意义,医脉通特邀任胜祥教授进行精彩点评,从研究者的视角为ES-SCLC的治疗带来更多启示。
(SCLC)占肺癌的10%-15%,其恶性程度高、进展迅速,尤其是ES-SCLC的预后更差,亟需探索有效的治疗策略。近期,同济大学附属上海市肺科医院任胜祥、吴凤英教授团队和中国科学院上海生物化学与细胞生物学研究所陈洛南教授团队在MedComm上发表了一项揭示MYC-Notch轴表达差异是广泛期小细胞肺癌(ES-SCLC)异质性及差异性治疗应答基础的研究。为深入了解研究的意义,医脉通特邀任胜祥教授进行精彩点评,从研究者的视角为ES-SCLC的治疗带来更多启示。
研究背景
近年来,尽管化疗联合免疫检查点抑制剂已成为SCLC的一线标准治疗,患者生存获益有限,且缺乏疗效预测标志物。既往研究提示,中央型与周围型SCLC在临床病理特征、分子机制及预后方面存在差异,但其治疗反应差异的生物学机制尚未阐明。本研究旨在解析ES-SCLC异质性,探索其治疗应答差异的深层机制。
研究方法
研究通过整合265例ES-SCLC患者的临床数据,系统比较中央型与周围型患者对化疗及化疗免疫联合治疗的疗效差异。同时,采用单细胞RNA测序(scRNA-seq)对9例初治ES-SCLC患者的肿瘤样本进行高分辨率解析,从肿瘤细胞和微环境两个维度分析分子特征。并整合IMpower133临床试验的公开数据,进一步验证关键分子标志物的预测价值。
研究结果
研究入组的265例接受一线化疗或化学免疫治疗的ES-SCLC患者中,中央型和周围型分别为207例(78.1%)和58例21.9%),两者分别有140例和125例患者接受了化疗和化疗免疫联合治疗。化疗组包括111例(79.3%)中央型患者和29例(20.7%)周围型患者,化疗免疫联合治疗组包括96例(76.8%)中央型患者和29例(23.2%)周围型患者。
结果显示,化疗组患者的客观缓解率(ORR)为65.7%,疾病控制率(DCR)为87.8%。周围型的ORR(44.8% vs. 71.2%,p=0.008)和DCR(75.9% vs. 91.0%,p=0.026)均显著低于中央型。此外,中央型和周围型的总中位无进展生存期(PFS)和总生存期(OS)分别为4.6个月和12.9个月。周围型的的中位PFS(3.4个月 vs. 5.1个月,p=0.001)和中位OS(11.6个月 vs. 13.3个月,p=0.268)均显著短于中央型。
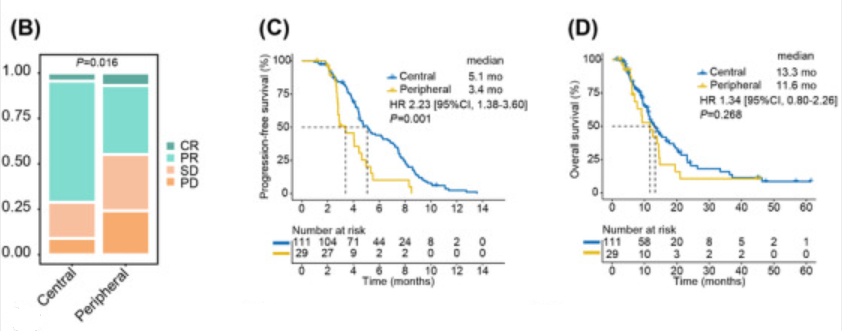
接受化疗的患者(n=111和29,分别为中央型和周围型)的最佳反应堆叠条形图(B)、PFS生存曲线(C)、OS生存曲线(D)
在化疗免疫联合治疗组中,所有患者的ORR和DCR分别为74.4%和94.4%。两种类型的ES-SCLC表现出相当的ORR(75.9% vs. 74.0%,p=0.837)和DCR(96.6% vs. 93.8%,p=0.909)。中位PFS和中位OS分别为6.8个月和15.1个月。周围型和中央型的中位PFS分别为6.8个月 vs. 6.8个月(p=0.217),中位OS分别为16.8个月 vs. 14.8个月(p=0.156)。
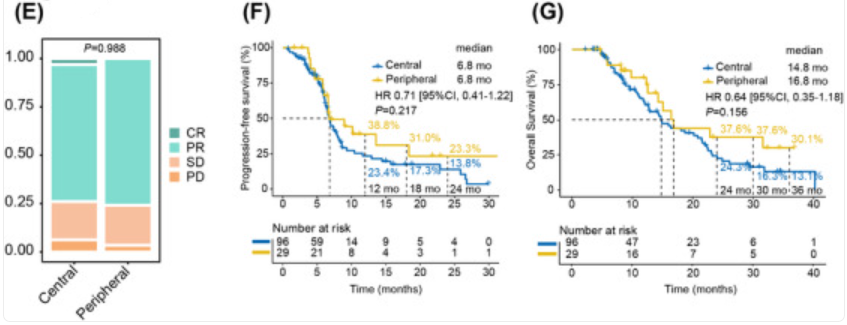
接受化疗免疫联合治疗的患者(n=96和29,分别为中央型和周围型)的最佳反应堆叠条形图(E)、PFS生存曲线(F)、OS生存曲线(G)
由于化疗免疫联合治疗是ES-SCLC的标准一线治疗,研究者进一步将其性能与化疗进行了比较。患者基线特征是平衡的。总患者(6.8个月 vs. 4.6个月,p<0.001)、中央型患者(6.8个月 vs. 5.1个月,p<0.001)和周围型患者(6.8个月 vs. 3.4个月,p<0.001)接受化疗免疫联合治疗后均表现出显著更长的PFS。值得注意的是,周围型(16.8个月 vs. 11.6 个月,p=0.023)在接受化疗免疫联合治疗时表现出显着的OS改善,而中央型(14.8 vs. 13.3 个月,p=0.615)仅显示数值延长。且死亡风险降低更显著(HR:0.44 vs. 0.91,95% CI)。
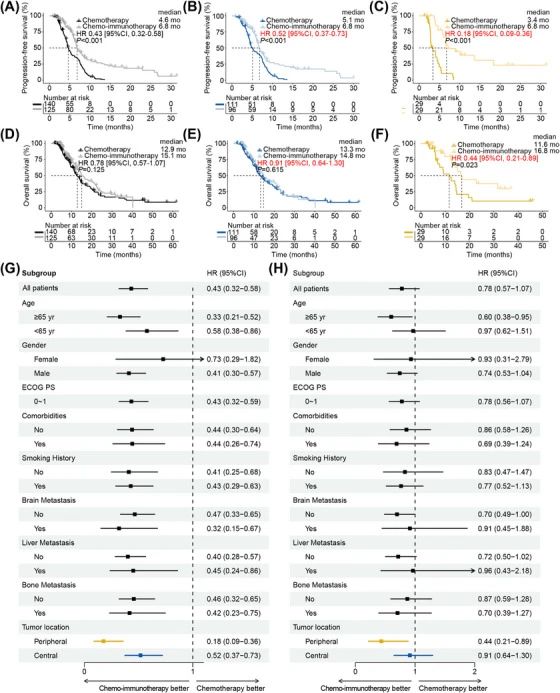
总患者(A)、中央型患者(B)、周围型患者(C)的PFS生存曲线。
总患者(D)、中央型患者(E)、周围型患者(F)的OS生存曲线。
总患者的PFS(G)、OS(H)亚组分析森林图。
单细胞测序揭示,周围型ES-SCLC中MYC-Notch轴异常激活驱动化疗耐药,同时其微环境呈现更强的抗原呈递及免疫激活特征。同时,相应机制也在IMpower133研究数据中得到充分验证。此外,研究还发现抑制性Notch配体DLL3的低表达被证实是化疗联合免疫治疗疗效的独立预测因子。
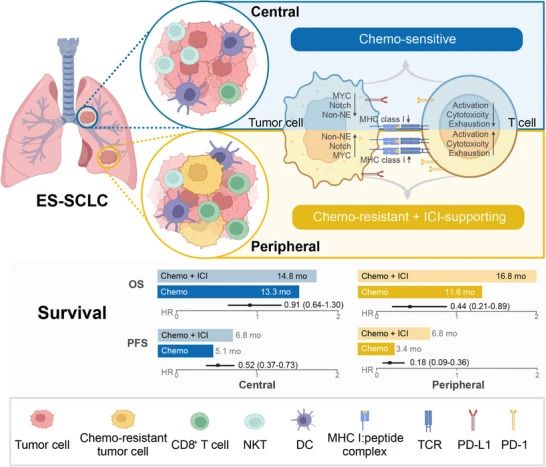
研究示意图
研究结论
该研究从分子层面阐明了中央型与周围型ES-SCLC治疗应答差异背后的机制,周围型ES-SCLC化疗耐药性源于MYC-Notch-non-NE轴激活,但其免疫微环境特征使化疗免疫联合治疗获益更显著。DLL3表达水平可作为疗效预测标志物,为个体化治疗提供理论依据。靶向MYC-Notch轴或DLL3或可改善ES-SCLC治疗策略。
研究者说
任胜祥教授:
该研究通过整合临床队列分析与单细胞测序技术,系统揭示了中央型与周围型ES-SCLC对一线治疗反应差异的分子机制,具有重要的临床转化价值。研究创新性地发现MYC-Notch轴的异常激活是周围型ES-SCLC化疗耐药的关键驱动因素,而此类肿瘤同时具备更强的免疫原性微环境,从而在化疗免疫联合治疗中获益更显著。这一发现不仅解释了既往临床观察到的治疗异质性,还为精准治疗策略的制定提供了分子依据。值得注意的是,DLL3低表达作为疗效预测标志物的验证,为未来个体化治疗方案的优化提供了潜在靶点。然而,研究样本量尤其是周围型病例仍相对有限,且机制研究主要基于回顾性分析,未来需通过前瞻性队列及功能实验进一步验证。总体而言,该研究为突破ES-SCLC治疗瓶颈提供了新的理论支撑,靶向MYC-Notch通路或联合免疫治疗的策略值得深入探索。


