
2025 ASCO速递 | 朱耀教授:PTEN缺陷预警生存危机,双通路狙击驱动前列腺癌精准治疗升级
前言
2025年美国临床肿瘤学会(ASCO)研讨会于5月30日至6月3日在芝加哥召开,汇集了众多肿瘤领域的权威专家,一起分享、探讨国际前沿的临床肿瘤学科研成果和肿瘤诊疗技术。在本次大会中,摘要5096探索了真实世界中转移性激素敏感性前列腺癌 (mHSPC)患者磷酸酶与张力蛋白同源物基因(PTEN)突变模式,并分析了PTEN状态对患者治疗模式和总生存期(OS)的影响。医脉通特邀复旦大学附属肿瘤医院朱耀教授为我们解读该研究结果,并深入探讨PTEN检测的应用潜力,挖掘PTEN检测在前列腺癌患者诊疗中的作用。
(mHSPC)患者磷酸酶与张力蛋白同源物基因(PTEN)突变模式,并分析了PTEN状态对患者治疗模式和总生存期(OS)的影响。医脉通特邀复旦大学附属肿瘤医院朱耀教授为我们解读该研究结果,并深入探讨PTEN检测的应用潜力,挖掘PTEN检测在前列腺癌患者诊疗中的作用。
研究背景
目前,恶性肿瘤已经进行个体化精准诊疗时代。在前列腺癌中,乳腺癌 易感基因(BRCA)、同源重组修复(HRR)、肿瘤蛋白53(TP53)、视网膜母细胞瘤
易感基因(BRCA)、同源重组修复(HRR)、肿瘤蛋白53(TP53)、视网膜母细胞瘤 基因1(RB1)和PTEN等生物标志物与患者不良预后相关,疾病进展快,现有治疗方案有效性有限。因此,如何制定有效的精准靶向治疗策略尤为关键。
基因1(RB1)和PTEN等生物标志物与患者不良预后相关,疾病进展快,现有治疗方案有效性有限。因此,如何制定有效的精准靶向治疗策略尤为关键。
PTEN缺陷常见于侵袭性、难治性前列腺癌中,在原发性前列腺癌患者中发生率约为15% ~ 20%;在mHSPC患者中发生率为39%;如进展至转移性去势抵抗性前列腺癌(mCRPC),PTEN缺陷的发生率将升高至40% ~ 60%[1,2]。PTEN是磷脂酰肌醇 3-激酶/AKT/哺乳动物雷帕霉素靶蛋白(PI3K/AKT/mTOR)通路的负性调控因子,PTEN缺陷会导致PI3K通路过度激活,促进前列腺癌细胞生长、增殖和侵袭[3]。但对于mHSPC患者,我们对不同PTEN突变状态亚组的患者特征、治疗模式和生存结局的了解有限。本次ASCO年会中摘要5096分析了PTEN状态在mHSPC患者预后中的价值,为mHSPC的临床实践提供更多循证医学证据[4]。
3-激酶/AKT/哺乳动物雷帕霉素靶蛋白(PI3K/AKT/mTOR)通路的负性调控因子,PTEN缺陷会导致PI3K通路过度激活,促进前列腺癌细胞生长、增殖和侵袭[3]。但对于mHSPC患者,我们对不同PTEN突变状态亚组的患者特征、治疗模式和生存结局的了解有限。本次ASCO年会中摘要5096分析了PTEN状态在mHSPC患者预后中的价值,为mHSPC的临床实践提供更多循证医学证据[4]。
研究方法
这是一项回顾性队列研究,使用Flatiron Health-Foundation Medicine匿名化处理后的转移性前列腺癌基因组学数据。研究纳入了2018年1月1日~ 2024年3月31日确诊为mHSPC且接受了实体肿瘤全面基因组分析的患者。携带PTEN基因突变的患者被分为PTEN纯合缺陷(纯合缺陷定义为拷贝数变异[CNV]=0)或PTEN突变(CNV=1,病理性的短变异改变或重排)。其他患者定义为未携带PTEN突变。对患者特征及治疗模式进行描述性分析。评估不同PTEN突变状态的患者真实世界总生存期(rwOS;未调整)的Kaplan-Meier生存概率。
研究结果
患者特征
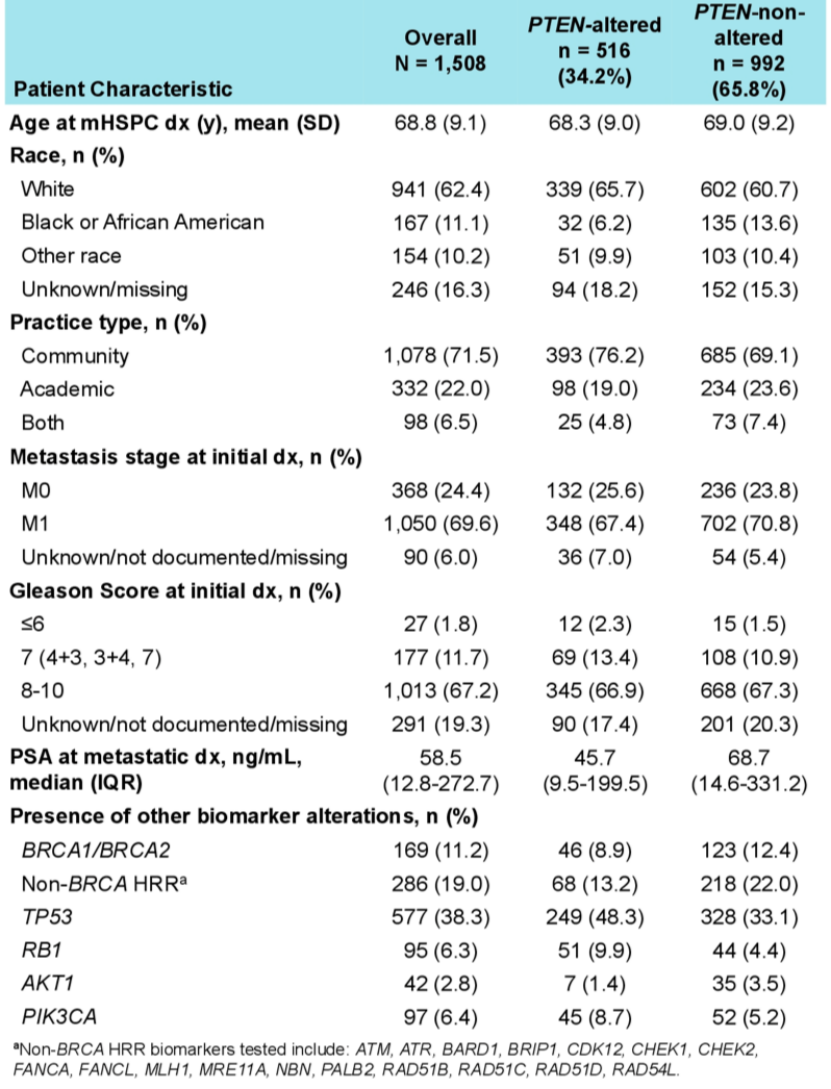
本研究最终分析纳入了1508例mHSPC患者,其中34.2%的患者携带PTEN突变(表 1)。总体而言,患者确诊为mHSPC时平均年龄为68.8岁(标准差9.1)。初始确诊时,67.2%的患者Gleason评分为8 ~ 10分,69.6%的患者为原发性mHSPC。在确诊转移时,携带PTEN突变的患者为黑人或非裔美国人的比例高于未携带PTEN突变的患者(6.2% vs. 13.6%),中位PSA低于未携带PTEN突变的患者(中位数[IQR]:45.7 [9.5 ~ 199.5] vs. 68.7 [14.6 ~ 331.2])。与未携带PTEN突变的患者相比,携带PTEN突变的患者HRR突变比例更低(非BRCA HRR:13.2% vs. 22.0%;BRCA1/2:8.9% vs. 12.4%),TP53(48.3% vs. 33.1%)和RB1(9.9% vs. 4.4%)突变比例更高。
表1 不同PTEN状态患者特征
治疗模式
无论患者是否携带PTEN突变,最常见的mHSPC一线治疗方案为单独雄激素剥夺治疗(ADT)或雄激素受体通过抑制剂(ARPI,图 1)。
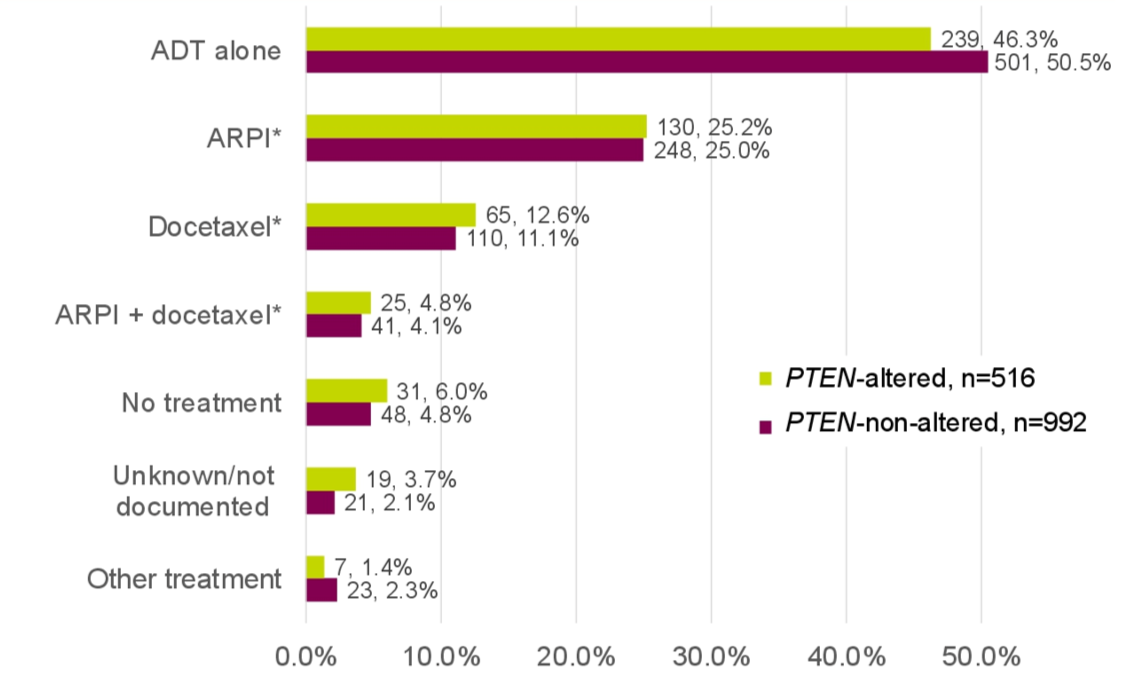
图1 不同PTEN状态患者一线治疗模式
rwOS
总体而言,与未携带PTEN突变的患者相比,携带PTEN突变的患者中位rwOS更短(33.4 [29.3 ~ 38.2] vs. 43.5 [39.7 ~ 47.9]个月,图 2),而且在新发的mHSPC患者中也观察到相似趋势(图 3)。
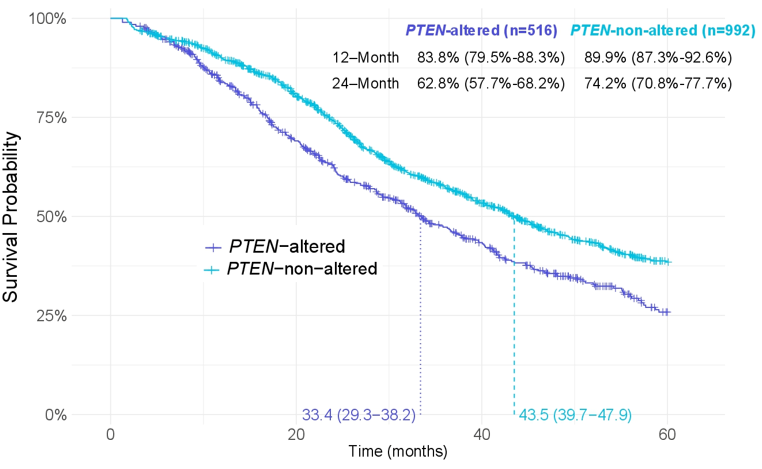
图2 不同PTEN状态患者rwOS
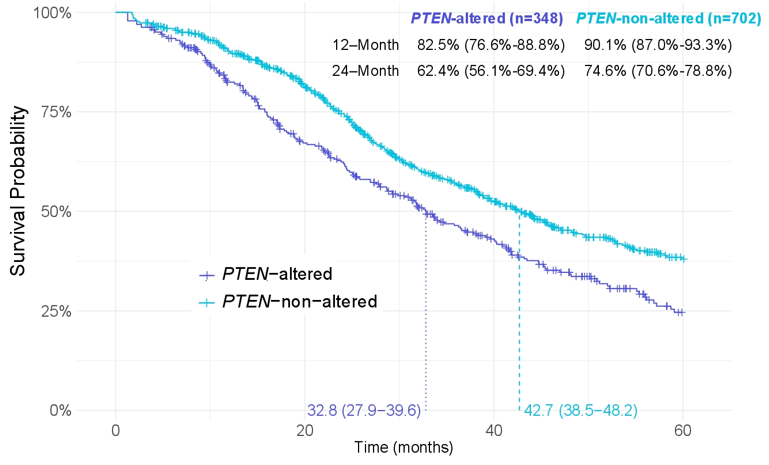
图3 不同PTEN状态的新发mHSPC患者rwOS
对于mHSPC患者,无论一线使用单独ARPI(图 4a)、多西他赛 (图 4b)还是ADT(图 4c),携带PTEN突变的患者较未携带PTEN突变的患者rwOS均更短。
(图 4b)还是ADT(图 4c),携带PTEN突变的患者较未携带PTEN突变的患者rwOS均更短。
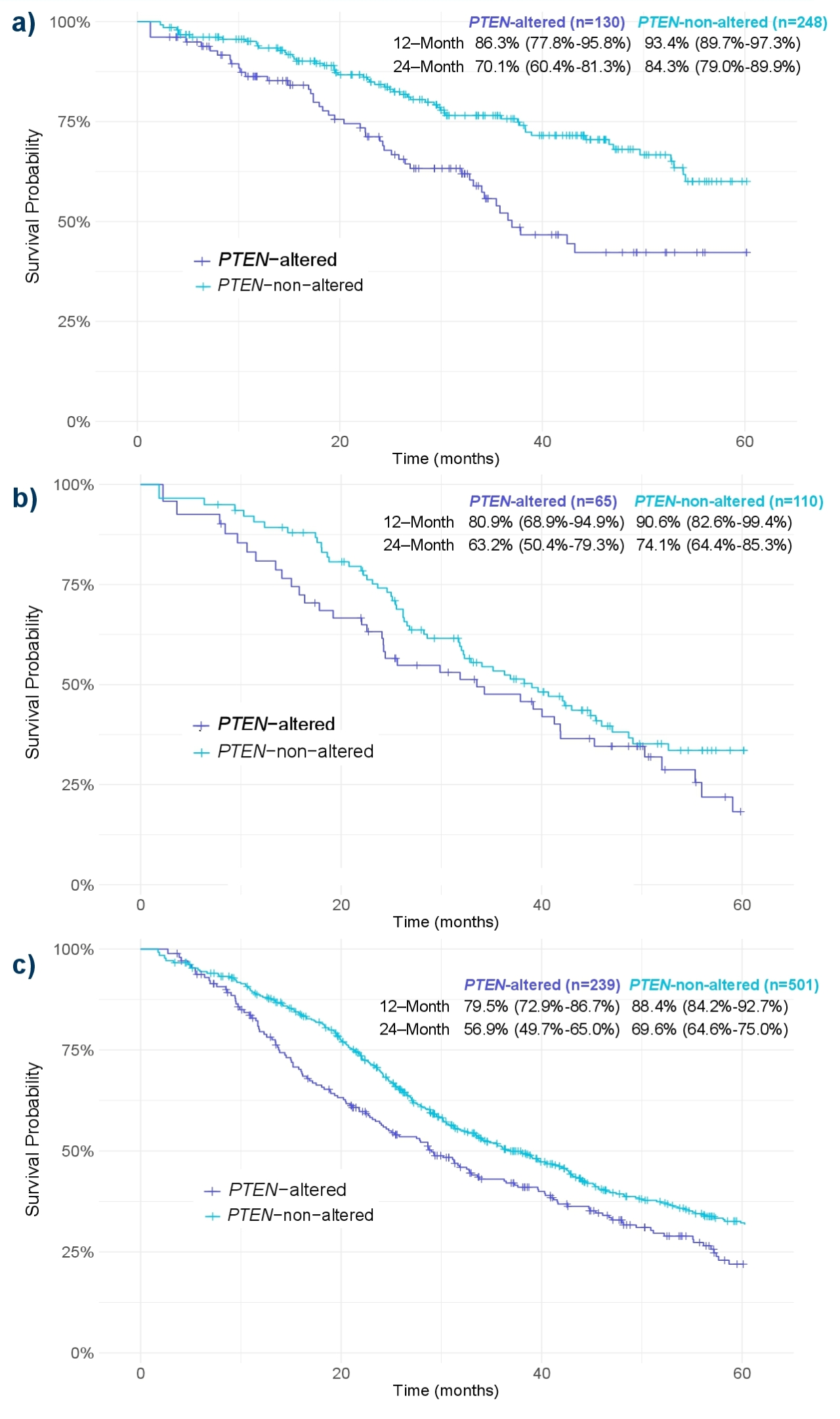
图4 不同PTEN状态、不同mHSPC一线方案患者rwOS;a,ARPI;b,多西他赛;c,ADT
研究结论
在所有mHSPC患者中,尽管PTEN各组之间的患者特征和治疗模式相似,但携带PTEN突变患者的OS较未携带PTEN突变的患者更差。
专家点评
朱耀 教授:
目前,我国前列腺癌的诊疗已进入“精准医学”时代。其中免疫组织化学(IHC)代表的蛋白表达检测技术已经得到了广泛应用,包括对前列腺癌的辅助病理诊断与鉴别,指导治疗决策、预后评估、监测治疗反应与复发等,越来越多的患者从前列腺癌精准治疗中获益。
摘要5096结果提示我们,在其他基线特征相似的患者中,即使采用了相同的治疗模式,PTEN突变患者生存获益更差。同时,我们注意到本次ASCO年会中摘要5003报道的STAMPEDE辅助研究得到了相似结论。该研究结果显示,50%的转移性前列腺癌患者存在PTEN失活(采用既往建立的特征谱定义:Liu et al JCI,2021年;激活评分≤0.3,失活评分> 0.3),接受ADT + ARPI方案治疗的患者PTEN失活与较短的OS相关(HR = 1.56,95% CI 1.06 ~ 2.31)[5]。
此外,在中国相关研究中也有类似结果。通过IHC PTEN检测发现,中国新发的转移性前列腺癌患者PTEN缺陷的发生率为28.3%。PTEN缺陷患者的中位无进展生存期(PFS,43.8 vs. 80.2个月,P < 0.001)和中位OS(11.9 vs. 30.6个月,P < 0.001)较未携带PTEN缺陷突变的患者均显著更短[6]。
综合以上研究结果,PTEN缺陷与mHSPC患者的预后显著相关。除了用于预后预测外,前列腺癌患者进行IHC PTEN检测还可以用于指导治疗决策。PTEN缺陷会抑制雄激素受体(AR)转录因子活性,导致前列腺上皮分化和存活减少。此外,对AKT激活具有负反馈调节作用的FKBP5-PHLPP受AR信号调节,PTEN缺陷会在激活PI3K/AKT信号通路的同时减少AR对FKBP5-PHLPP负反馈环路的调节作用。二者具有协同作用,将进一步过度激活AKT,导致前列腺上皮通过非雄激素/AR信号途径增殖。因此,可以通过AKT抑制剂Capivasertib联合ARPI阿比特龙 同时抑制AKT和雄激素两个信号通路,从而抑制前列腺癌细胞增殖(图5)[7]。基于此,全球、多中心、随机、双盲对照III期CAPItello-281研究正在对该方案的有效性进行探索。
同时抑制AKT和雄激素两个信号通路,从而抑制前列腺癌细胞增殖(图5)[7]。基于此,全球、多中心、随机、双盲对照III期CAPItello-281研究正在对该方案的有效性进行探索。
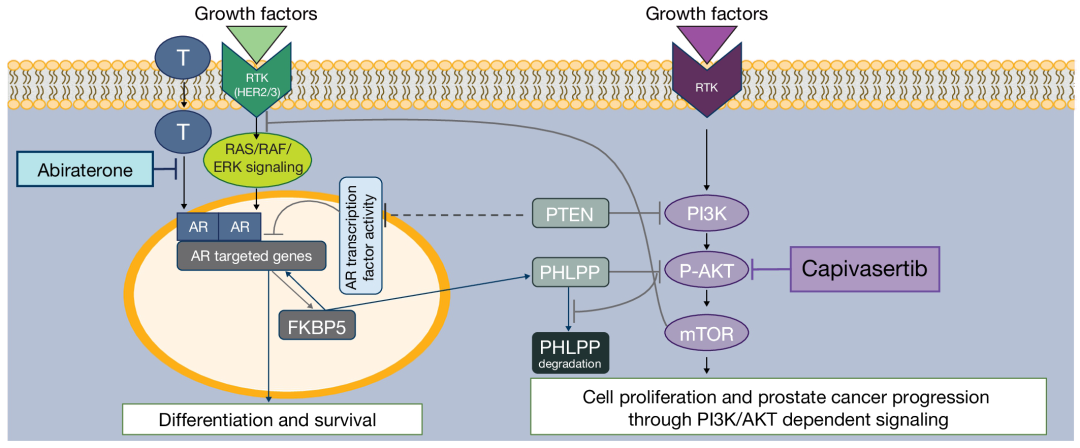
图5 Capivasertib联合阿比特龙作用机制
目前,CAPItello-281研究结果提示,对于新发mHSPC伴IHC检测PTEN缺陷患者,capivasertib联合阿比特龙对比安慰剂联合阿比特龙在主要研究终点影像学无进展生存期(rPFS)方面显示出统计学意义和临床意义的改善[8]。
综上所述,PTEN缺陷显著影响前列腺癌患者的预后,IHC PTEN检测结果也将影响治疗决策。借助于精准医疗的发展,结合IHC PTEN检测与临床数据,我们在未来将继续完善前列腺癌精准治疗策略,为每位患者量身定制个体化治疗方案,提高治疗效果。同时,未来的研究应继续关注PTEN缺陷的生物学意义和相关的治疗干预,以期在前列腺癌的治疗中取得更大突破。
结语
在精准医学时代,PTEN缺陷的识别和针对性治疗成为改善前列腺癌患者预后的关键。通过IHC检测,我们能够深入了解患者的PTEN状态,从而制定更为精准的治疗方案。特别是在PTEN缺陷的患者中,AKT抑制剂联合ARPI可以通过PI3K/AKT/mTOR与雄激素/AR双重信号通路的抑制实现更有效的肿瘤细胞抑制,进而提升患者的治疗效果。未来,我们期待更多临床研究揭示PTEN缺陷的生物学机制及其对治疗决策的影响,补充相关治疗方案的数据,为前列腺癌治疗提供更有力的循证证据支持。


扫码查看ASCO大会精彩资讯

