
洞见前沿丨徐开林教授、李振宇教授:抗GPRC5D CAR-T细胞作为抗BCMA CAR-T细胞治疗后进展的RRMM患者挽救治疗
对于抗B细胞成熟抗原(BCMA)嵌合抗原受体(CAR)T细胞治疗后进展的多发性骨髓瘤 (MM)患者,最佳挽救治疗策略仍不清楚。G蛋白偶联受体C类第5组成员D(GPRC5D)主要在骨髓瘤细胞表面表达,独立于BCMA,且GPRC5D在骨髓瘤细胞中过表达与MM患者的不良预后相关,使其成为一个有前途的治疗靶点。目前有少量临床试验报道,在一些抗BCMA CAR-T细胞治疗后出现疾病进展的MM患者中,抗GPRC5D CAR-T细胞可以获得治疗反应。然而,这部分患者数量较少,抗GPRC5D CAR-T细胞在抗BCMA CAR-T进展患者中的有效性和安全性需要在更大的队列中得到证实。
(MM)患者,最佳挽救治疗策略仍不清楚。G蛋白偶联受体C类第5组成员D(GPRC5D)主要在骨髓瘤细胞表面表达,独立于BCMA,且GPRC5D在骨髓瘤细胞中过表达与MM患者的不良预后相关,使其成为一个有前途的治疗靶点。目前有少量临床试验报道,在一些抗BCMA CAR-T细胞治疗后出现疾病进展的MM患者中,抗GPRC5D CAR-T细胞可以获得治疗反应。然而,这部分患者数量较少,抗GPRC5D CAR-T细胞在抗BCMA CAR-T进展患者中的有效性和安全性需要在更大的队列中得到证实。
徐州医科大学附属医院血液科开展了一项单臂、开放标签、2期临床试验。评估了抗GPRC5D CAR-T细胞在抗BCMA CAR-T细胞治疗后进展的MM患者中的有效性、安全性。该研究近日发表于《The Lancet Haematology》。通讯作者为徐开林 教授、李振宇教授和张鸿声教授,第一作者为夏洁云、孙乾和周典医生。
教授、李振宇教授和张鸿声教授,第一作者为夏洁云、孙乾和周典医生。

研究结果
1. 患者基线特征
2021年12月1日至2024年5月1日期间,筛查了42例复发难治性MM患者,共纳入37例。患者中位年龄为59岁(范围:31~70),37例中有17例(46%)为男性(表1)。从患者MM诊断明确到接受抗GPRC5D CAR-T细胞输注的中位间隔时间为5.2年(范围:1.4~18.6)。在37例患者中,11例(30%)患者为R-ISS III期,21例(57%)患有髓外疾病,15例(41%)具有高肿瘤负荷,16例(43%)具有高危细胞遗传学异常。22例(59%)患者为三重难治性疾病。既往治疗的中位数为6(范围:3~12)。
14例(38%)患者在最后一次抗BCMA CAR-T细胞治疗进展后,抗GPRC5D CAR-T细胞输注前接受了后续的抗骨髓瘤治疗,其中6例(16%)患者接受了基于CD38单克隆抗体的治疗,4例(11%)接受了基于卡非佐米 的治疗,4例(11%)接受了基于塞利尼索
的治疗,4例(11%)接受了基于塞利尼索 的治疗。其他23例患者未接受后续抗骨髓瘤治疗,直接输注抗GPRC5D CAR-T细胞进行挽救治疗。
的治疗。其他23例患者未接受后续抗骨髓瘤治疗,直接输注抗GPRC5D CAR-T细胞进行挽救治疗。
表1
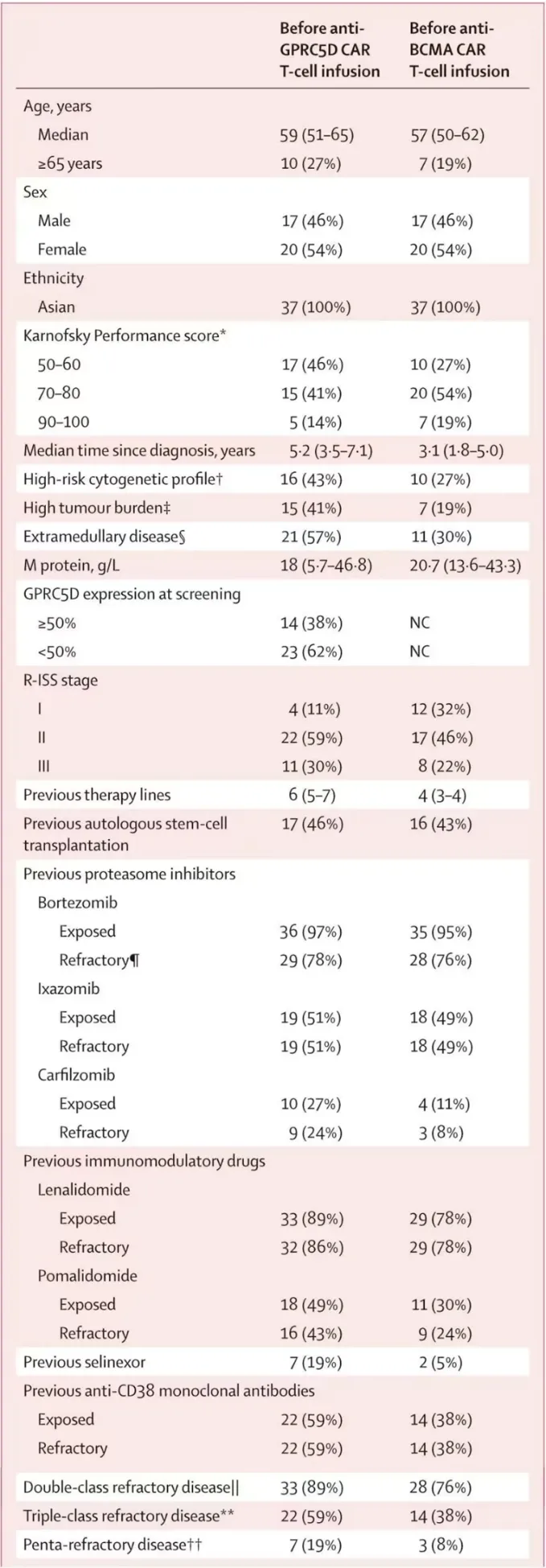
2. 治疗反应
截止日期(2024年7月31日)时,中位随访时间为12.6个月(范围:1.3~31.7)。总体反应率(ORR)为84%(31/37;95%CI 68~94),包括8例(22%)达严格意义的完全缓解(sCR),4例(14%)完全缓解(CR),4例(14%)非常好的部分缓解(VGPR)和13例(35%)部分缓解(PR);图1,图2A)。在抗BCMA CAR-T细胞治疗后仅有生化进展的11例患者中,有10例(91%)观察到反应,其中64%(11例患者中有7例)达到CR或更好(图2B)。在4例既往接受过反复抗BCMA CAR-T细胞输注并出现疾病进展的患者中,抗GPRC5D CAR-T细胞治疗的反应率为100%,其中1例患者达到CR。
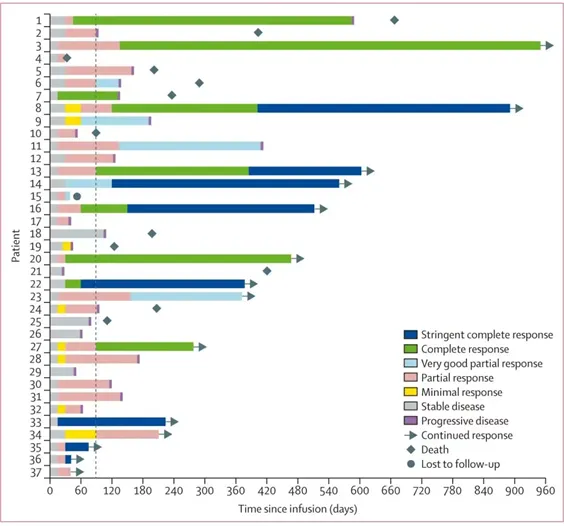
图1
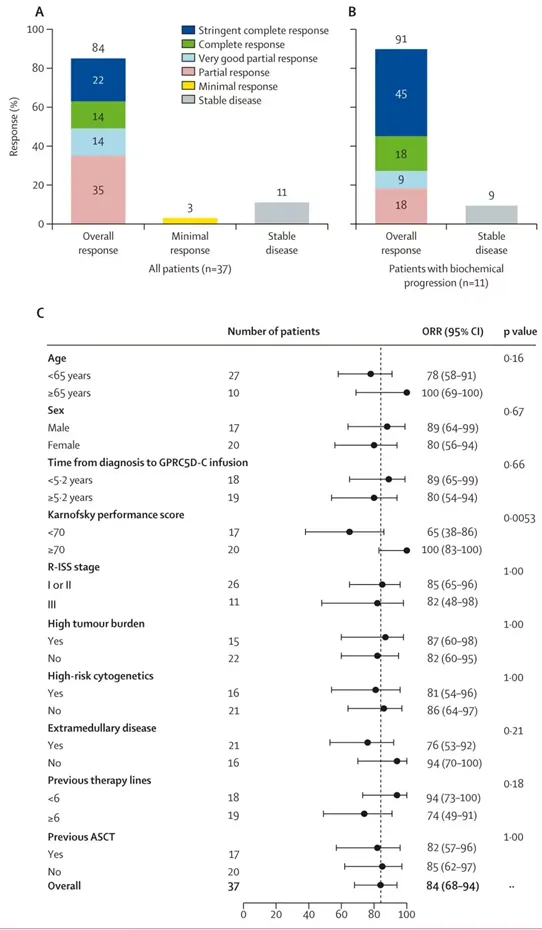
图2
在抗GPRC5D CAR-T细胞治疗之前,14例患者在最后一次抗BCMA CAR-T细胞治疗进展后接受了后续的抗骨髓瘤治疗。后续抗骨髓瘤治疗的ORR为21%(3/14),其中33%(2/6)的患者对基于抗CD38单克隆抗体的治疗有反应,25%(1/4)对基于卡非佐米的治疗有反应,0%(0/4)对基于塞利尼索的治疗有反应。这14例患者接受抗GPRC5D CAR-T细胞治疗的患者ORR为71% (10/14),显着高于既往抗骨髓瘤一般治疗的反应率(P=0.039)。
根据患者的年龄、性别、R-ISS分期、肿瘤负荷、是否存在高危细胞遗传异常、GPRC5D表达、是否合并髓外病变等临床特点,对ORR进行亚组分析。在单变量分析中,高KPS评分是与更好的ORR相关的变量(P=0.0053,图2C)。≥6线治疗和髓外病变患者的缓解率似乎较低,但通过单变量分析没有显着的统计学差异。在所有37例患者中,20例(54%,95% CI,37~71)达到骨髓MRD阴性。
整个队列的中位无进展生存期(PFS)为4.5个月(95% CI,2.9~6.2),CR或更好的患者的中位PFS未达到(图3)。达到CR或更好疗效的患者在CAR-T细胞输注后12个月时的PFS率为91%(95% CI,51~99)。
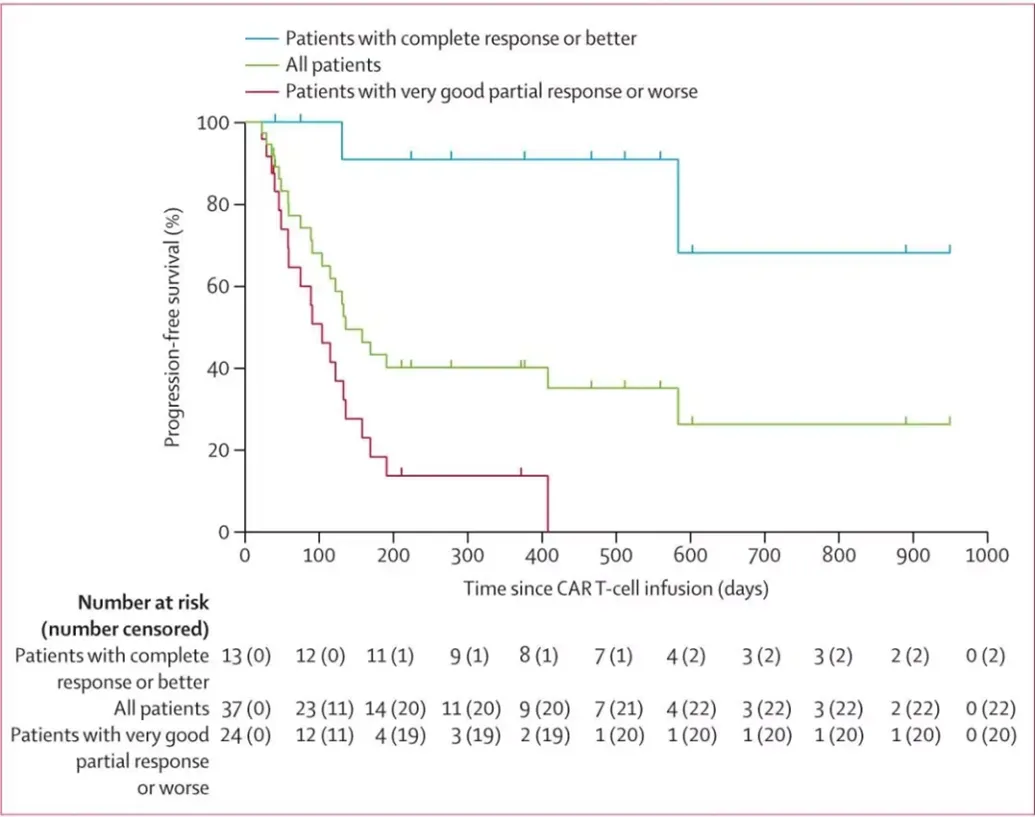
图3
3. 安全性
CAR-T细胞输注后最常见的不良事件(AE)是血液学毒性(表2)。3级或更高级别的血液学AE包括白细胞减少(37例患者中34例[92%])、中性粒细胞减少(29例[78%])、贫血 (23例[62%])和血小板减少(23例[62%])。在所有37例患者中,22例(59%)患者在淋巴细胞清除化疗前出现血细胞减少,包括14例(38%)白细胞减少,19例(51%)贫血,16例(43%)血小板减少。
(23例[62%])和血小板减少(23例[62%])。在所有37例患者中,22例(59%)患者在淋巴细胞清除化疗前出现血细胞减少,包括14例(38%)白细胞减少,19例(51%)贫血,16例(43%)血小板减少。
表2
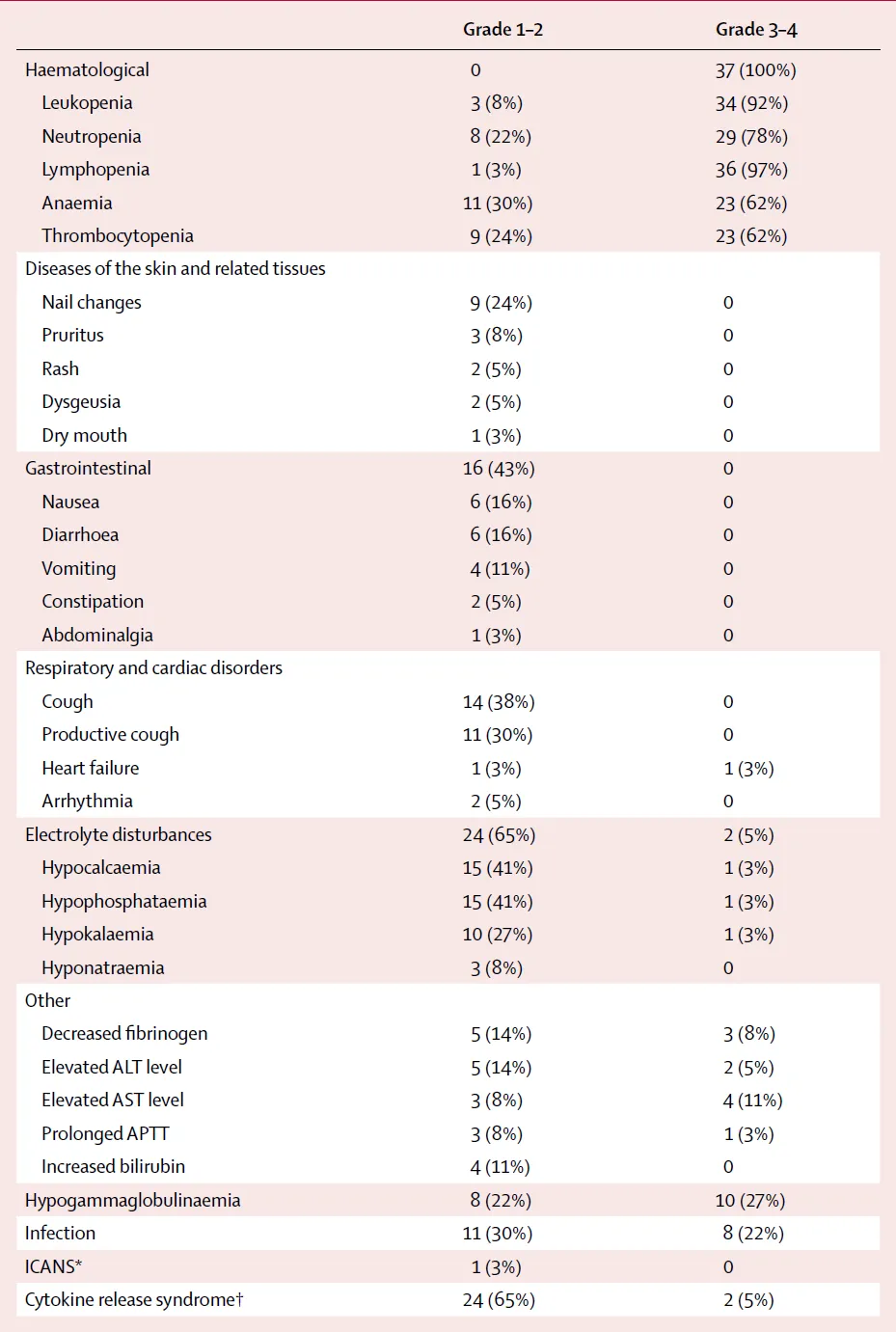
37例患者中有26例(70%)发生细胞因子释放综合征(CRS),多为1级或2级(24例[65%],表2)。本部分37例患者在既往接受抗BCMA CAR-T细胞治疗后CRS的发生率为95%。ICANS仅在输注后第5天发生于1例(3%)患者(1级),持续2天,使用甲泼尼龙 治疗后消失。
治疗后消失。
与皮肤和角化组织中GPRC5D表达相关的靶上/非肿瘤毒性作用表现为9例(24%)患者1级指甲脱落,2例(5%)1级皮疹 ,2例(5%)1级味觉障碍,1例(3%)口干(表2)。指甲疾病和口干无需任何干预即可解决。皮疹用局部糖皮质激素
,2例(5%)1级味觉障碍,1例(3%)口干(表2)。指甲疾病和口干无需任何干预即可解决。皮疹用局部糖皮质激素 治疗或仅仅观察后迅速消失。
治疗或仅仅观察后迅速消失。
研究结论
接受多线既往治疗的MM患者在抗BCMA CAR-T细胞治疗后进展,挽救性输注抗GPRC5D CAR-T细胞可获得高反应率。早期开始抗GPRC5D CAR-T细胞治疗,尤其是在仅存在MM生化进展时,有助于患者获得更好的疗效。
专家点评
李振宇教授:该研究立足于抗BCMA CAR-T细胞治疗后进展的MM临床治疗困境,创新性设计了一项单中心II期前瞻性临床试验,系统性探索了靶向GPRC5D CAR-T细胞疗法在此类患者中的疗效与安全性。研究结果显示,GPRC5D CAR-T细胞在RRMM患者中展现出令人鼓舞的缓解率和可控的安全性,特别是对于接受过多线既往治疗的MM患者在抗BCMA CAR-T细胞治疗后进展,挽救性输注抗GPRC5D CAR-T细胞也可获得较高反应率。该研究为BCMA CAR-T细胞治疗后进展的MM患者提供了切实可行的挽救治疗方案,并提出挽救治疗应选择在患者仅存在生化进展的情况下尽早启动,有助于获得更好的疗效,具有重要的临床指导和转化意义。

徐开林 教授
博士,Ⅱ级教授,博士生导师
徐州医科大学血液病 研究所所长
研究所所长
徐州医科大学造血干细胞移植 中心主任
中心主任
江苏省骨髓干细胞重点实验室主任
中国医师协会血液科医师分会常委
江苏省血液学分会前任主任委员
江苏省医师协会血液科医师分会会长
国家自然科学基金初审、终审专家
卫生部及江苏省有突出贡献的中青年专家
享受国务院政府特殊津贴
作为课题负责人承担科研课题20余项,其中主持国家自然科学基金重点项目1项,面上项目8项,省部级课题10余项,发表论文180余篇,其中包括JCO,Blood,Lancet Haematology,Leukemia,Haematologica,Am J Hematol 等杂志发表SCI收录论文90篇。以第一获奖者先后获得科技成果奖16项,其中教育部高等学校科学研究优秀成果奖(科学技术)二等奖2项,中华医学科技奖三等奖1项,省科技进步二等奖1项。

李振宇 教授
徐州医科大学附属医院 血液科科主任,教授,博士生导师
江苏省骨髓干细胞研究所副所长
中华医学会血液学分会委员
中国医师协会血液科分会委员
中国抗癌协会血液肿瘤专委会委员
中华医学会血液学分会浆细胞疾病学组委员
中国医师协会血液科分会多发性骨髓瘤专委会委员
江苏省医学会血液学分会候任主任委员
江苏省医师协会血液科分会副会长
江苏省抗癌协会血液肿瘤专委会副主任委员
江苏省医学重点人才、江苏省“333”二层次培养对象、江苏省“六大高峰”人才培养对象、江苏省“科教强卫”医学重点人才
国家自然科学基金评审专家
发表文章50余篇,SCI论文40余篇。参编人民卫生出版社出版的《CAR-T细胞免疫治疗学》;主持和参与多项国家级、省级基金。
参与制定多个国家级诊疗规范与指南:嵌合抗原受体T细胞治疗多发性骨髓瘤,中国血液临床专家共识(2022年版);淋巴浆细胞淋巴瘤/华氏巨球蛋白血症 诊断与治疗中国指南(2022年版);中国首次复发多发性骨髓瘤诊治指南(2022年版);套细胞淋巴瘤
诊断与治疗中国指南(2022年版);中国首次复发多发性骨髓瘤诊治指南(2022年版);套细胞淋巴瘤 诊断与治疗中国指南(2022 年版);多发性骨髓瘤疗效评估与微小残留病监测中国指南(2024年版);中国多发性骨髓瘤诊治指南(2024年修订);高危多发性骨髓瘤诊断与治疗中国专家共识(2024年版)
诊断与治疗中国指南(2022 年版);多发性骨髓瘤疗效评估与微小残留病监测中国指南(2024年版);中国多发性骨髓瘤诊治指南(2024年修订);高危多发性骨髓瘤诊断与治疗中国专家共识(2024年版)
研究方向:多发性骨髓瘤的基础及临床


