
JASN 前沿进展 | 探索新型生物标志物,揭示CKD预后评估的”多维度密码“
前言
慢性肾脏病 (CKD)可显著增加肾衰竭
(CKD)可显著增加肾衰竭 、心血管事件和全因死亡风险,随着疾病进展,患者可能出现全身多系统并发症,且不同个体的疾病进展速度和并发症风险存在明显差异。传统生物标志物如估算肾小球滤过率(eGFR)和尿白蛋白/肌酐比值(UACR)在CKD的诊断和管理中发挥了重要作用,但难以深入解析CKD的异质性和疾病进展的复杂性。
、心血管事件和全因死亡风险,随着疾病进展,患者可能出现全身多系统并发症,且不同个体的疾病进展速度和并发症风险存在明显差异。传统生物标志物如估算肾小球滤过率(eGFR)和尿白蛋白/肌酐比值(UACR)在CKD的诊断和管理中发挥了重要作用,但难以深入解析CKD的异质性和疾病进展的复杂性。
近期,《JASN 》发布了一项研究“Biomarkers of Kidney Failure and All-Cause Mortality in CKD.”(IF=9.6),通过系统评估多组学生物标志物,旨在优化风险预测并深化CKD机制认知。
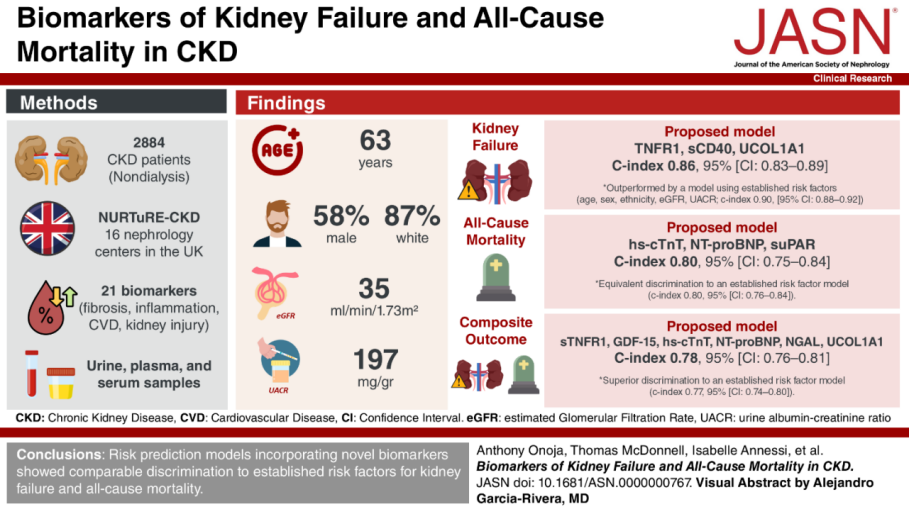
近年来,CKD特异性预测指标需求推动生物标志物研究快速发展。大型队列研究(如CanPREDDICT和CRIC)已评估多种新型标志物,但其临床应用受限,主要因预测效能未能显著超越KFRE等现有模型。现有风险因素已具备良好预测性能,新型标志物的价值更可能体现在机制探索方面:为个体化治疗、疗效监测和新药研发提供依据。然而,最具临床价值的标志物组合尚未明确。
NURTuRE-CKD研究通过系统评估多组学生物标志物,旨在优化风险预测并深化机制认知。研究聚焦与肾脏损伤/纤维化、炎症及心血管疾病 相关的血清、血浆和尿液标志物——这些病理过程既是CKD的驱动因素,也是其并发症基础。该研究既验证已知标志物,也探索新型标志物在肾衰竭和死亡预测中的潜力。
相关的血清、血浆和尿液标志物——这些病理过程既是CKD的驱动因素,也是其并发症基础。该研究既验证已知标志物,也探索新型标志物在肾衰竭和死亡预测中的潜力。
NURTuRE-CKD是一项正在进行的英国多中心前瞻性队列研究,纳入了来自英国16个肾病 中心的2884例未接受透析治疗的成年CKD患者,并招募86名无CKD的成人对照(含23名糖尿病
中心的2884例未接受透析治疗的成年CKD患者,并招募86名无CKD的成人对照(含23名糖尿病 患者及63名非糖尿病患者)。CKD患者入组标准为eGFR 15-59mL/min/1.73m²,或eGFR≥60mL/min/1.73m²,且UACR>300mg/g。排除标准包括:实体器官移植史、正在接受透析治疗、预期生存期不足一年、入组前三个月内发生急性肾损伤
患者及63名非糖尿病患者)。CKD患者入组标准为eGFR 15-59mL/min/1.73m²,或eGFR≥60mL/min/1.73m²,且UACR>300mg/g。排除标准包括:实体器官移植史、正在接受透析治疗、预期生存期不足一年、入组前三个月内发生急性肾损伤 或重大心血管事件、当前正在接受癌症化疗。
或重大心血管事件、当前正在接受癌症化疗。
 锂抗凝血浆及血清)中检测,包括KIM-1(血浆肾损伤分子-1)、suPAR(可溶性尿激酶
锂抗凝血浆及血清)中检测,包括KIM-1(血浆肾损伤分子-1)、suPAR(可溶性尿激酶 型纤溶酶原
型纤溶酶原 激活剂受体)、CRP(C反应蛋白)、GDF-15(生长分化因子15)、NT-proBNP(N末端脑钠肽原)、Hs-cTnT(高敏心肌肌钙蛋白
激活剂受体)、CRP(C反应蛋白)、GDF-15(生长分化因子15)、NT-proBNP(N末端脑钠肽原)、Hs-cTnT(高敏心肌肌钙蛋白 T)、sCD40(可溶性炎症因子CD40)、sCD40L(可溶性炎症因子CD40配体)、FGF-23(成纤维细胞生长因子23)、Galectin-3(半乳糖凝集素3)、MCP-1(单核细胞趋化蛋白1)、NGAL(中性粒细胞明胶
T)、sCD40(可溶性炎症因子CD40)、sCD40L(可溶性炎症因子CD40配体)、FGF-23(成纤维细胞生长因子23)、Galectin-3(半乳糖凝集素3)、MCP-1(单核细胞趋化蛋白1)、NGAL(中性粒细胞明胶 酶相关脂质运载蛋白)及sTNFR1(可溶性肿瘤坏死因子受体1)。8项在未离心尿液中检测(U)(未离心尿液分析更贴近临床常规尿检实践),包括Ucalbindin(钙结合蛋白)、UKIM-1(尿肾损伤分-1)、Uclusterin(簇集蛋白)、Uosteactivin(骨激活素)、UVEGF(血管内皮生长因子)、UTIMP-1(金属蛋白酶组织抑制剂-1)、UMMP-9(基质金属蛋白酶-9)、UCOL1A1(I型胶原α1链)。其中,12项主要与肾脏损伤/纤维化相关(KIM-1,UKIM-1,NGAL,suPAR,Uclusterin,Uosteactivin,Ucalbindin,UCOL1A1,UTIMP-1,UMMP-9),5项与炎症相关(sCD40,sCD40L,sTNFR1,CRP,MCP-1),4项与心血管疾病相关(Hs-cTnT,NT-proBNP,GDF-15,FGF-23)。
酶相关脂质运载蛋白)及sTNFR1(可溶性肿瘤坏死因子受体1)。8项在未离心尿液中检测(U)(未离心尿液分析更贴近临床常规尿检实践),包括Ucalbindin(钙结合蛋白)、UKIM-1(尿肾损伤分-1)、Uclusterin(簇集蛋白)、Uosteactivin(骨激活素)、UVEGF(血管内皮生长因子)、UTIMP-1(金属蛋白酶组织抑制剂-1)、UMMP-9(基质金属蛋白酶-9)、UCOL1A1(I型胶原α1链)。其中,12项主要与肾脏损伤/纤维化相关(KIM-1,UKIM-1,NGAL,suPAR,Uclusterin,Uosteactivin,Ucalbindin,UCOL1A1,UTIMP-1,UMMP-9),5项与炎症相关(sCD40,sCD40L,sTNFR1,CRP,MCP-1),4项与心血管疾病相关(Hs-cTnT,NT-proBNP,GDF-15,FGF-23)。受试者基线特征
根据不同研究终点分组的CKD队列基线数据见表1。CKD组患者平均年龄为63(±15)岁,其中58%为男性,87%为白人。eGFR为35(25~47)ml/min/1.73m²,中位UACR为197(32~895)mg/g。对照组平均年龄56岁,男性占比37%,其中27%合并糖尿病。
表1. 2884例CKD受试者的基线人口学与临床特征
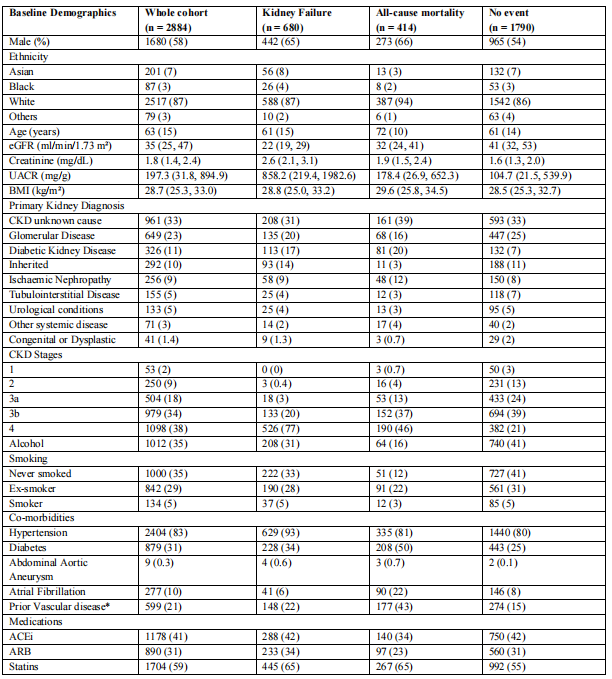
关键指标包括估算肾小球滤过率(eGFR)、尿白蛋白/肌酐比值(UACR)、体重指数(BMI)等。
数据呈现方式:分类变量:例数(百分比),正态分布连续变量(如年龄):均值,偏态分布连续变量:中位数(第25,75百分位数)
关键定义:饮酒:自我报告每周摄入超过14单位酒精,既往血管疾病*:包含冠状动脉血运重建、心肌梗死、卒中、外周血管疾病及截肢的复合终点,删失数据:基线至末次随访未发生肾衰竭或全因死亡的CKD患者,肾衰竭:首次出现持续eGFR<15ml/min/1.73m²或开始肾脏替代治疗,死亡:发生肾衰竭前的全因死亡
数据缺失情况:UACR 248例(8.6%),BMI 77例(2.7%),饮酒史919例(31.9%),吸烟史908例(31.5%),合并症(高血压/糖尿病/腹主动脉瘤/房颤)各59例(2.0%),既往血管疾病295例(10.2%),用药情况(ACE抑制剂/ARB/他汀类)各40例(1.4%)
表2显示了CKD患者按肾功能分期及对照组的生物标志物浓度中位水平。其中5种生物标志物(UKIM-1、suPAR、Uclusterin、sCD40、GDF-15)在糖尿病对照组的表达水平显著高于非糖尿病对照组。除sCD40L外,所有生物标志物在CKD患者中的浓度均高于对照组;仅sCD40L和UMMP-9未呈现随肾功能下降而升高的趋势。
表2. CKD患者与对照组的生物标志物浓度比较
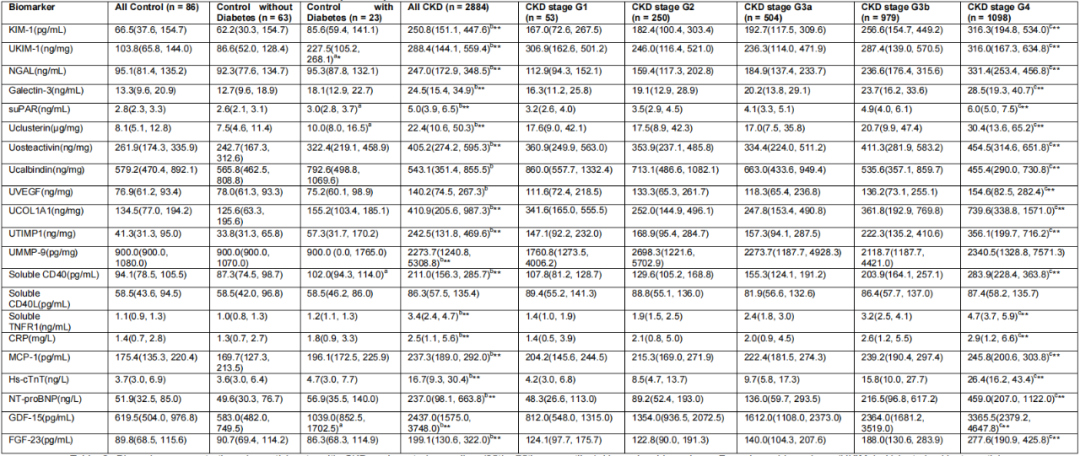
括号外上标字母表示组间统计学差异:a:糖尿病对照组 vs 非糖尿病对照组,b:全部CKD患者 vs 全部对照组,c:CKD G1-G4期 vs 全部CKD患者的趋势分析,显著性水平:*p<0.001,**p<0.0001(仅标注字母表示p<0.05),所有p值均经Bonferroni校正
生物标志物与肾衰竭的关联性分析
在中位随访时间48个月期间,680例受试者进展至肾衰竭。其中629例受试者eGFR<15 ml/min/1.73m²,另有51例受试者在达到该阈值前已开始肾脏替代治疗(KRT)(42例接受透析,9例接受肾移植)。经临床协变量(年龄、性别、白种人、基线eGFR和UACR)校正后的基线生物标志物浓度关联分析结果如图1a所示。
在肾脏损伤/纤维化相关生物标志物中:血浆KIM-1、suPAR、UCOL1A1和Uclusterin与肾脏衰竭呈正相关,Ucalbindin、UMMP-9和UVEGF则呈负相关。
炎症相关生物标志物:sCD40、MCP-1和sTNFR1与更高的肾脏衰竭风险相关。
心血管疾病相关生物标志物:Hs-cTnT和GDF-15同样与肾脏衰竭风险升高相关。
按eGFR分层分析显示大多数与肾脏衰竭显著相关的生物标志物在三个eGFR分层中的两个仍保持显著性。值得注意的是:Uclusterin和Ucalbindin仅在eGFR<45ml/min/1.73m²组别中显著,UVEGF、Hs-cTnT及炎症标志物sCD40、sTNFR1仅在eGFR<30ml/min/1.73m²组别中显著。
生物标志物与全因死亡率的关联性分析
在CKD队列中,共观察到414例肾衰竭前的全因死亡事件。经完全校正模型分析显示,9种肾脏损伤/纤维化标志物(血清及尿液KIM-1、NGAL、suPAR、Uclusterin、Uosteactivin、Ucalbindin、UVEGF、UTIMP-1)、4种炎症标志物(sCD40、sTNFR1、CRP、MCP-1)以及4种心血管疾病标志物(Hs-cTnT、NT-proBNP、GDF-15、FGF-23)均与全因死亡风险升高显著相关(图1b)。按eGFR分层分析时,多数标志物仍保持显著关联性:Ucalbindin、UVEGF和UTIMP-1仅在eGFR 30-45ml/min/1.73m²亚组中显著,而NGAL仅在终末期组中显著。
生物标志物组合与肾衰竭或全因死亡复合终点的关联性分析
在完全校正模型中,8种肾脏损伤/纤维化标志物(血浆及尿液KIM-1、NGAL、suPAR、Uclusterin、Uosteactivin、UCOL1A1、UTIMP-1)、4种炎症标志物(sCD40、sTNFR1、CRP、MCP1)及全部4种心血管标志物与肾衰竭/死亡复合终点显著相关(图1c)。eGFR分层分析显示:NGAL、UVEGF和MCP-1仅在最晚期阶段显著,而UKIM-1、UTIMP-1、Uosteactivin和Ucalbindin在早中期阶段显著但在最晚期无统计学意义。
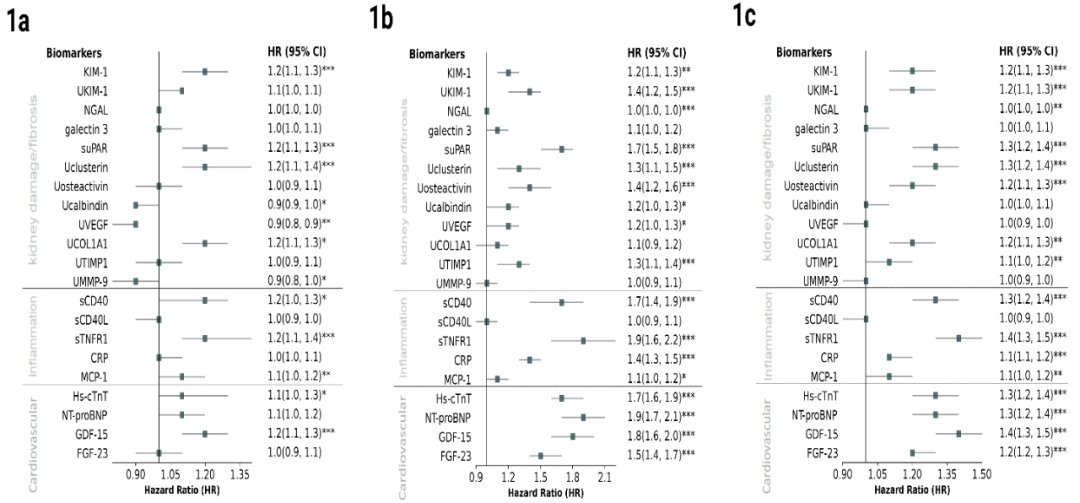
图1. 生物标志物与(a)肾脏衰竭、(b)全因死亡率及(c)肾脏衰竭或全因死亡复合结局的校正风险比
生物标志物组合对肾衰竭与全因死亡的鉴别效能
表3展示了包含传统风险因素与新型生物标志物(单独或联合)的风险预测模型一致性指数(C-index),经平衡模型简洁性与性能后,最优模型包含以下生物标志物:
• 肾脏衰竭模型:sTNFR1、sCD40、UCOL1(C-index 0.86;95%CI:0.83-0.89)
• 全因死亡模型:hs-cTnT、NT-proBNP、suPAR(C-index 0.80;95%CI:0.75-0.84)
• 复合终点模型:sTNFR1、GDF-15、hs-cTnT、NT-proBNP、NGAL、UCOL1A1(C-index 0.78;95%CI:0.76-0.81)
表3. 传统风险因素与新型生物标志物(单独或联合)的风险预测模型C-index
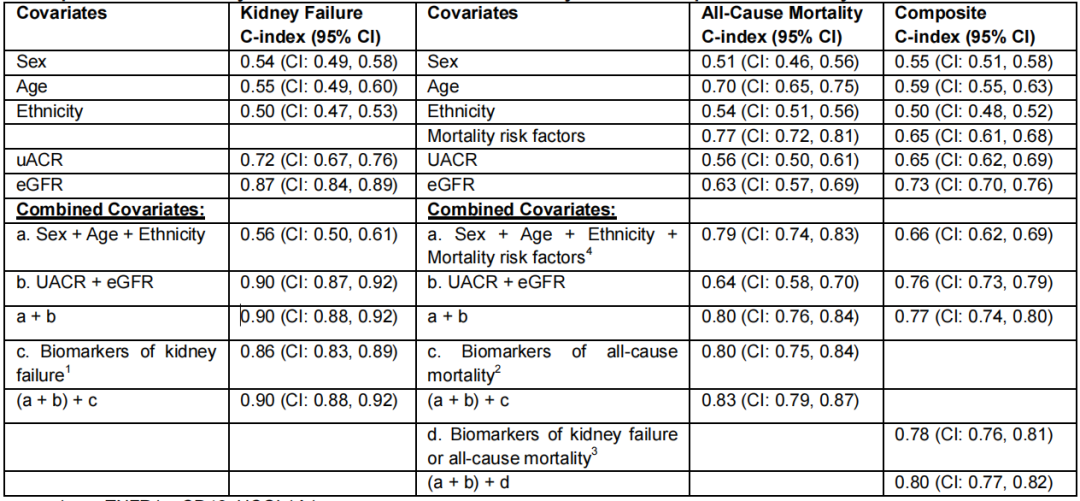
1.sTNFR1, sCD40, UCOL1A1
2.hs-cTnT, NT-proBNP, suPAR
3.sTNFR1, GDF-15, hs-cTnT, NT-proBNP, NGAL, UCOL1A1
4.死亡率风险因素:多重剥夺指数评分,吸烟,饮酒,糖尿病,高血压,既往血管性疾病(包括冠状动脉血运重建术、心肌梗死、卒中、外周血管疾病、截肢的复合指标),他汀类药物使用,血管紧张素转换酶抑制剂/血管紧张素II受体阻滞剂(ACEi/ARB)使用
