
一文总结 | 免疫 “失守” 下的脓毒症:从机制到诊疗的深度解码

脓毒症作为一种由感染引发的危及生命的宿主反应失调综合征,一直是重症医学领域的研究重点。在免疫功能低下人群中,脓毒症的发生、发展及诊治过程具有显著特殊性,近年来相关研究取得了一系列重要进展,为临床实践提供了新的思路和方向。
感染与脓毒症是两个截然不同的概念,脓毒症必然存在感染,但感染未必发展为脓毒症。全球范围内,脓毒症是导致全球发病和死亡的重要原因。在美国,约3%的成年人存在免疫功能低下状态,这使得他们的感染控制和清除能力受损。免疫抑制可分为先天性和获得性,前者如原发性免疫缺陷病,后者包括重症获得性免疫缺陷或医源性因素等。
值得注意的是,免疫功能低下不仅增加感染风险,还会影响脓毒症的预后。例如,因先天性免疫缺陷、合并症或接受化疗、放疗、糖皮质激素等治疗而出现免疫功能障碍的患者,感染致死风险显著高于免疫正常人群。此外,当器官、组织或细胞抵抗压力的能力有限时,器官衰竭更容易发生且进展迅速。然而,目前很少有临床研究单独报告这些不同风险,这使得死亡率风险预测变得困难。
免疫抑制的核心是机体对病原体的免疫防御功能减弱,可影响体液免疫和细胞免疫。先天免疫和适应性免疫反应的失调可通过多种机制发生,即使是低毒力病原体和共生菌也可能在严重免疫功能低下患者中引发危及生命的感染,疱疹病毒的再激活也会加剧脓毒症的病程和严重程度。
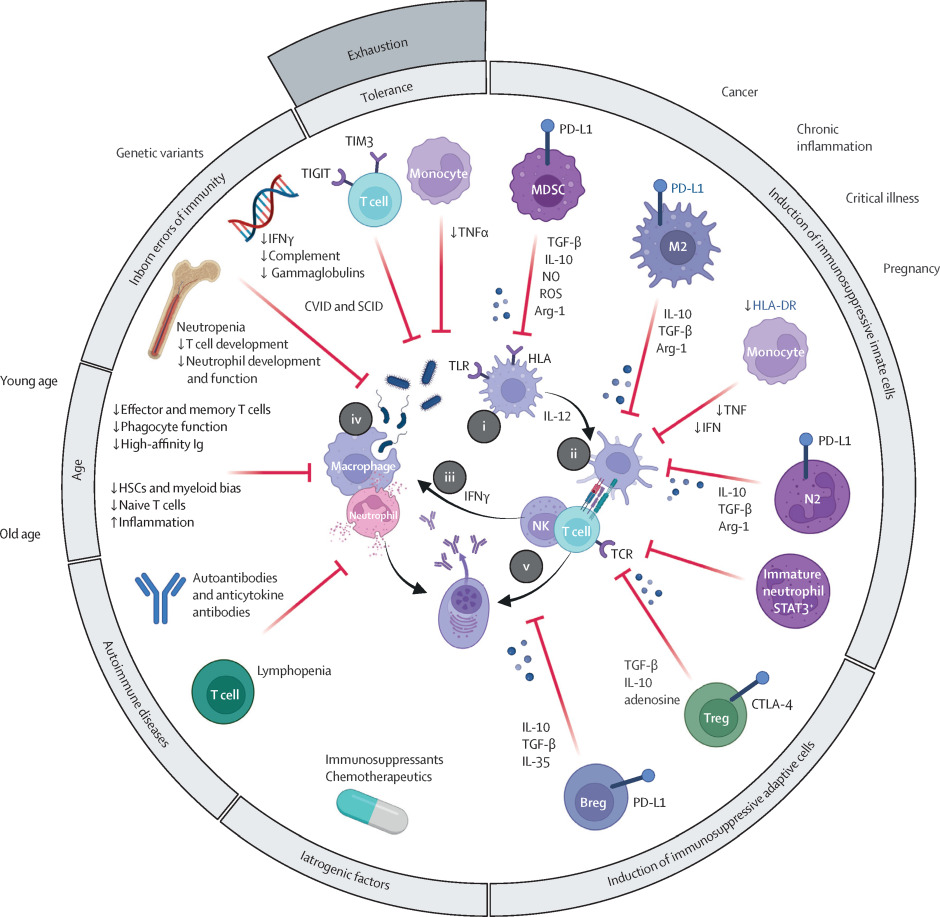
图 免疫防御和促进免疫抑制的脓毒症相关机制
模式识别受体与免疫激活的失衡
免疫细胞通过进化保守的模式识别受体(PRRs)识别病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)。Toll样受体(TLRs)是PRRs的重要组成部分,其基因的单核苷酸多态性(SNPs)与成人和新生儿感染及脓毒症的易感性和预后相关。例如,TLR4变异会降低与细菌脂多糖的相互作用,增加革兰氏阴性菌感染引起脓毒症的vulnerability;TLR1变异与创伤后脓毒症患者的死亡风险升高相关。
核苷酸结合寡聚化结构域样受体(NLR)家族可组装成炎症小体,响应各种PAMPs和细胞应激源,触发促炎反应。NLRs中的SNPs,尤其是NLRC5,与肺曲霉病的易感性相关。然而,炎症小体的失调或过度激活会导致免疫抑制,损害抗菌防御。
补体、中性粒细胞与免疫记忆的异常
补体系统或中性粒细胞发育障碍会使个体易患严重感染和脓毒症。常见变异型免疫缺陷(CVID)主要与低丙种球蛋白血症相关,多表现为非脓毒性鼻窦肺部感染,而严重联合免疫缺陷(SCID)则因缺乏功能性T细胞和B细胞,导致患者易受强毒和机会性病原体感染。
过去认为只有适应性免疫细胞具有记忆功能,近年来研究发现先天免疫也存在记忆,即“先天免疫记忆”,其通过表观遗传修饰实现。例如,卡介苗(BCG)疫苗可增强先天免疫细胞对二次免疫挑战的反应,而暴露于细菌脂多糖等免疫刺激物则会导致免疫耐受,这种耐受虽能在某些情况下抑制过度炎症反应,但也会对免疫防御产生负面影响。
适应性免疫抑制的多重机制
适应性免疫抑制可直接由负性检查点受体信号(如PD-1、CTLA-4、TIGIT和TIM-3)的病理性上调或抑制性免疫细胞(如调节性T细胞、调节性B细胞、髓系来源抑制细胞和未成熟中性粒细胞)的积累引起,也可间接由抗原呈递不足(如抗原呈递细胞表面MHCII类分子HLA-DR的下调)导致。基于临床、生物标志物和转录组学数据的亚表型研究显示,脓毒症具有异质性,需要个体化的诊断和治疗方法。
免疫抑制可由多种因素引起,包括原发性免疫缺陷、年龄、获得性疾病和医疗干预等。区分脓毒症发生前的免疫抑制(即pre-existing免疫抑制)和脓毒症相关免疫抑制至关重要,后者在脓毒症发生和进展过程中形成。
原发性免疫缺陷病的免疫失衡
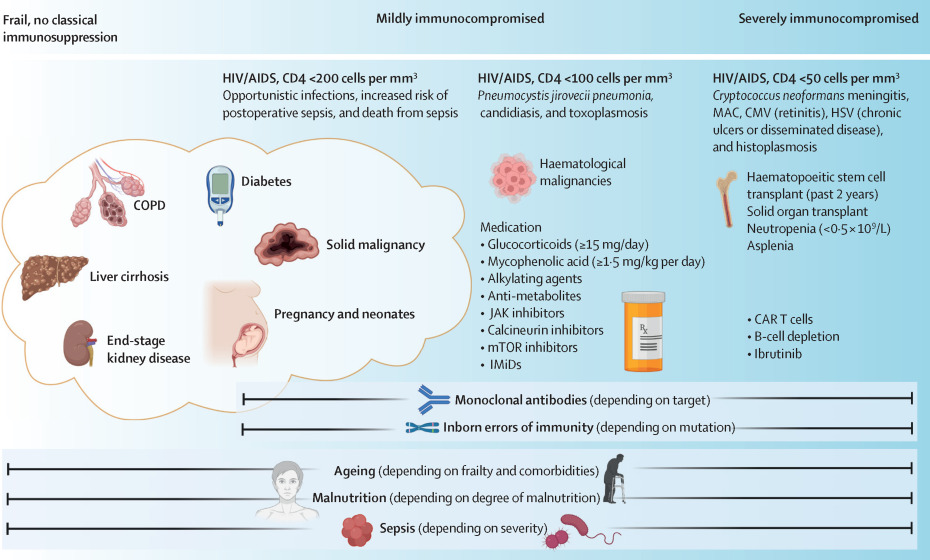
原发性免疫缺陷病(IEIs)是由种系突变引起的先天性疾病,国际免疫学会将其分为十类,超过500种遗传紊乱。IEIs影响免疫系统的不同组件,导致多样化的临床表现,为研究病原体抵抗的特定免疫效应器提供了机制性见解。例如,IFN-γ先天性缺陷会增加分枝杆菌感染易感性,AIRE基因突变与1型自身免疫性多腺体综合征相关,增加黏膜皮肤念珠菌病风险。PHENOMS研究发现,补体缺陷是儿童脓毒症中最常见的IEI特征。
年龄相关的免疫功能演变
儿童和老年人的脓毒症研究相对较少。儿童,尤其是新生儿和早产儿,免疫系统尚未成熟,1型和2型IFNs分泌有限,吞噬细胞抗菌反应降低,B细胞产生高亲和力抗体的能力不足,导致感染的易损性增加。随着年龄增长,儿童的体液免疫和细胞免疫功能逐渐发育,至青春期晚期达到成人水平。
衰老则以慢性全身性炎症、细胞衰老、免疫衰老和器官功能障碍为特征。老年人脓毒症是重症监护病房(ICU)入院的主要原因之一,其易感性增加的机制尚未完全明确,但包括初始T细胞减少、T细胞受体库受限、先天免疫细胞功能改变等。70岁以上人群中,自身抗体中和 I 型 IFN 的患病率从成人(18-69岁)的0.18%升至4-8%(70岁以上人群),这可能损害机体对流感、COVID-19和西尼罗河病毒脑炎等病毒感染的免疫防御。
自身免疫性疾病的重要影响
自身免疫性疾病源于免疫系统对健康组织的误识别、自身抗体产生和细胞免疫改变。抗细胞因子抗体(如抗IL-6、抗IL-17和抗IL-22)介导的疾病会使个体易患金黄色葡萄球菌和白色念珠菌感染。抗中性粒细胞胞浆抗体相关血管炎患者和系统性红斑狼疮伴淋巴细胞减少症患者的感染风险增加。流行病学数据显示,多发性硬化、类风湿关节炎、系统性红斑狼疮、原发性硬化性胆管炎和克罗恩病患者的脓毒症风险升高,但自身免疫性疾病患者发生脓毒症时,28天死亡风险较低。
实体器官移植临床挑战
实体器官移植显著破坏器官稳态,对患者免疫系统产生深远影响。移植后的解剖学改变(如肝移植后胆管炎)和免疫抑制方案均增加感染风险。脓毒症风险和预后因移植器官类型、免疫抑制方案和对脓毒症发展的认知而异。心脏或肺移植患者发生脓毒症后的死亡风险较高,而肾或肝移植患者的死亡风险低于未接受移植的脓毒症患者。
免疫抑制药物的复杂影响
免疫抑制药物的使用对脓毒症预后有复杂影响。多中心回顾性PACIFIC分析显示,使用免疫抑制药物的脓毒症患者死亡风险并不高于未使用药物的患者,但高剂量糖皮质激素(>15mg/天泼尼松等效剂量)与死亡风险增加相关,而生物疾病修饰抗风湿药和霉酚酸酯则与死亡风险降低相关。利妥昔单抗广泛用于治疗多发性硬化和B细胞恶性肿瘤,与严重感染和脓毒症风险增加相关,可导致迟发性中性粒细胞减少和低丙种球蛋白血症,进一步加剧危及生命的感染风险。
恶性肿瘤及其治疗的免疫抑制效应
超过20%的脓毒症相关住院患者患有癌症,癌症与脓毒症相关死亡风险增加相关。癌症患者发生脓毒症的风险升高,原因包括使用免疫抑制治疗和频繁的侵入性操作,导致病原体暴露增加和免疫防御受损,影响脓毒症生存率。化疗增加非脓毒症和脓毒症相关死亡风险,而放疗仅影响非脓毒症死亡率。化疗后中性粒细胞减少(中性粒细胞计数<500cells/μL)会增加严重感染风险,死亡率为5-13%。
血液系统恶性肿瘤患者在诊断后1年内约有12-27%会发生脓毒症,入住ICU的患者死亡风险增加。靶向B细胞成熟抗原的疗法(如双特异性抗体和嵌合抗原受体(CAR)T细胞疗法)具有较高的感染风险,前者与严重B细胞发育不全、低丙种球蛋白血症和免疫重建受损有关,后者最严重的感染发生在给药后第一个月。
HIV/AIDS与免疫重建的治疗困境
1981年首次描述的获得性免疫缺陷综合征(AIDS)与细胞免疫功能障碍相关,人类免疫缺陷病毒(HIV)靶向CD4受体,导致CD4细胞进行性耗竭和严重免疫抑制。CD4计数<200cells/mL的患者机会性感染率和脓毒症死亡率显著增加,而接受抗逆转录病毒治疗且CD4细胞计数正常的患者,感染性疾病严重程度和脓毒症死亡率并未增加。在资源有限的卫生系统中,实现世界卫生组织的95-95-95目标(到2030年,95%的HIV感染者得到诊断,95%接受持续抗逆转录病毒治疗,95%实现持续病毒抑制)对于改善患者预后至关重要。
免疫功能低下患者感染时的临床表现通常不典型或症状较轻,这会延迟感染的诊断和处理。常见的感染临床体征、生物标志物和症状可能缺失或不明显,如脓性分泌物和脓肿形成,这在明显中性粒细胞减少或淋巴细胞减少的患者中尤为明显。常规生物标志物如C反应蛋白、IL-6、降钙素原和白细胞计数在诊断免疫功能低下患者脓毒症时表现出不同的鉴别特异性,仅起辅助诊断作用。器官衰竭生物标志物如前肾上腺髓质素可能为改善免疫功能低下患者脓毒症检测提供新的机会。
社区获得性肺炎(CAP)是脓毒症的最常见原因,但免疫功能低下患者在CAP研究和相关指南中常被忽视。免疫功能低下患者CAP的临床表现与免疫正常患者不同,可能缺乏典型肺炎症状,初始表现稳定但病情可在数小时内迅速恶化,从中度肺炎进展为需要重症监护的重症肺炎。胸部X线检查可能无法显示肺部浸润,因此CT诊断对住院决策至关重要。传统的严重程度评分(如CURB-65和肺炎严重程度指数)未在免疫功能低下患者中验证,因此需要基于临床判断的低住院阈值,而缺氧是确定免疫功能低下患者适当护理环境的特别有用标准。
评估免疫抑制需要全面评估宿主特征和病原体参与情况。临床医生必须评估相关合并症的潜在存在,包括通过全外显子或IEI限制测序识别种系编码的易感性变异或突变。还应考虑反复感染的频率、近期器官移植史和免疫抑制剂的使用。实验室数据包括全血细胞计数和淋巴细胞亚群分析,免疫球蛋白和补体系统测量可提供更精确的证据,功能测定(如淋巴细胞增殖、中性粒细胞氧化爆发和吞噬能力)和激活标志物测量(如NK细胞IL-2受体和β2-微球蛋白)可提供关于先天和适应性免疫组件性能的最实质性证据。
对于疑似脓毒症的免疫功能低下患者,识别机会性感染具有重要诊断价值,关键病原体包括巨细胞病毒(CMV)、EB病毒(EBV)、结核分枝杆菌、铜绿假单胞菌、曲霉属和念珠菌属等。分子诊断方法是免疫功能低下疑似脓毒症患者有限微生物学诊断的有力替代方法,尤其是在培养阴性脓毒症中,宏基因组测序可快速识别传统培养方法可能遗漏的罕见或非典型病原体。此外,识别持续性和再激活的病毒感染可为检测免疫缺陷提供额外线索,如CMV、EBV和HSV常在免疫抑制期间发生再激活,可作为长期免疫抑制的指标。
脓毒症模拟综合征在重症患者中具有重要诊断意义,尤其是在免疫功能低下患者中。噬血细胞性淋巴组织细胞增生症(HLH)、巨噬细胞活化综合征、特发性肺炎综合征、血栓性微血管病和细胞因子释放综合征等临床综合征的特征是严重的免疫失调,可在无感染的情况下模拟脓毒症和重症疾病。HLH的特征是高铁蛋白血症,因此在疑似HLH的脓毒症患者中测量铁蛋白对诊断和治疗具有重要意义。
当前重症疾病的临床决策主要基于脓毒症的临床综合征,而忽视了患者的免疫特征。脓毒症患者的发病和死亡率存在显著差异,突显了这种过时的综合征为基础的方法的局限性。尽管已确定脓毒症的分子亚群(称为脓毒症内型或亚表型),但其对以患者为中心的结局的临床意义仍不确定。确定应评估哪些免疫特征以定义可治疗的亚表型是一个关键挑战,目前缺乏对免疫抑制的共识定义,无论其原因如何。
多个临床试验已将生物标志物纳入脓毒症不同亚表型的治疗分层,显示了更有针对性方法的可行性。基于生物标志物的试验对患者异质性相对宽容,因为治疗决策取决于生物标志物识别的特定疾病特征的存在。因此,预先排除大量患者(如先前免疫抑制患者)会降低科学发现的潜力。主要终点评估应辅以事后亚组分析,关注选定的脓毒症途径和反应类型,以实现最大的研究效能。
免疫刺激干预措施已在早期临床试验中测试,旨在靶向脓毒症相关免疫抑制,如使用GM-CSF、胸腺素α-1、IL-7、抗PD-1、抗PD-L1、IL-15或IFN-γ增强单核细胞、T细胞和树突状细胞功能。在PROVIDE和ImmunoSep研究中,患者根据铁蛋白升高(识别过度炎症)或单核细胞HLA-DR表达降低(识别免疫抑制)双向分层,接受anakinra(IL-1受体拮抗剂)或重组IFN-γ治疗。然而,这些临床试验并非旨在为先前免疫抑制患者提供明确的治疗解决方案。
精准靶向免疫刺激可恢复细胞免疫能力并改善临床终点。长期以来,“一刀切”的脓毒症治疗概念已被广泛认为过时,这在免疫功能低下和重症患者中尤为突出。免疫功能低下患者常因免疫反应复杂而被排除在随机对照试验之外,这增加了异质性并影响结果解释、治疗评估和方案标准化。建议免疫功能低下患者不应被排除在临床试验之外,尤其是在测试基于生物标志物的治疗方法时。排除免疫功能低下患者会限制研究结果在感染和脓毒症风险增加人群中的适用性。
单细胞RNA测序等技术为研究免疫功能障碍和脓毒症相关分子亚型提供了重要见解,如研究SRS1和SRS2亚群和COVID-19中的全身免疫反应。然而,尽管这些技术具有潜力,但在不同分子层的计算整合方面仍存在重大挑战,需要谨慎解释数据。
针对免疫功能低下患者的脓毒症预防策略可能是降低其高发病率和死亡率的有效方法。可采取的预防措施包括:及时接种流感和SARS-CoV-2疫苗、肺炎球菌疫苗等;维持足够的营养状态;治疗潜在的HIV和疟疾感染;加强卫生措施以防止细菌定植;在严重免疫抑制情况下进行暂时隔离;在合理情况下进行抗菌药物预防;加强医院和社区环境中的感染监测以早期发现;改进使用临床评分(如国家早期预警评分)识别脓毒症。此外,人工智能在医疗实践中的新兴应用可能支持多种预防措施,并有可能产生新的解决方案。
免疫功能低下患者因原发性免疫缺陷、获得性疾病和药物等多种因素,感染和随后进展为脓毒症的风险增加。鉴于合并症和药物对免疫系统的特定影响,不存在单一的免疫抑制状态,特定免疫功能的调节可能增加感染和脓毒症发展的风险。此外,感染风险增加并不一定意味着脓毒症风险增加。开发针对免疫功能低下脓毒症患者的特定临床和实验室标志物,将增强这一独特且普遍风险群体的预防措施、早期检测和最佳管理。未来的研究应致力于将免疫表型分析整合到临床决策中,开展包含免疫功能低下患者的临床试验,并开发精准的免疫调节疗法,以改善这一脆弱群体的预后。
参考文献:Deinhardt-Emmer S, Chousterman BG, Schefold JC, et al. Sepsis in patients who are immunocompromised: diagnostic challenges and future therapies. Lancet Respir Med. 2025 Jul;13(7):623-637.

