
中国强音 | 荣登顶刊,国产ADC引领CLDN18.2阳性胃癌精准治疗新浪潮
胃癌 (GC)是中国常见的恶性肿瘤,也是癌症死亡的主要原因之一。尽管一线化疗联合免疫或抗HER2治疗可延长部分患者生存,但后线治疗预后仍较差。抗体药物偶联物(ADC)凭借靶向性及低全身毒性优势成为研究热点,如抗HER2 ADC药物显著改善了HER2阳性晚期GC患者的总生存期(OS),但HER2阴性患者(占比≥80%)治疗选择有限。Claudin-18.2(CLDN18.2)在胃食管腺癌中高表达,已成为极具潜力的新靶点。开发新型CLDN18.2 ADC药物,有望为GC患者提供更优治疗策略。
(GC)是中国常见的恶性肿瘤,也是癌症死亡的主要原因之一。尽管一线化疗联合免疫或抗HER2治疗可延长部分患者生存,但后线治疗预后仍较差。抗体药物偶联物(ADC)凭借靶向性及低全身毒性优势成为研究热点,如抗HER2 ADC药物显著改善了HER2阳性晚期GC患者的总生存期(OS),但HER2阴性患者(占比≥80%)治疗选择有限。Claudin-18.2(CLDN18.2)在胃食管腺癌中高表达,已成为极具潜力的新靶点。开发新型CLDN18.2 ADC药物,有望为GC患者提供更优治疗策略。
2025年7月16日,中山大学肿瘤防治中心徐瑞华教授领衔全国多中心研究团队在国际顶级医学期刊Nature Medicine(IF=50.0)在线发表了一项突破性临床研究成果:靶向CLDN18.2的ADC药物SHR-A1904治疗晚期胃癌/胃食管结合部腺癌(GC/GEJC)的I期临床试验结果。该研究首次验证了拓扑异构酶I抑制剂类ADC在CLDN18.2阳性GC中的临床价值,丰富了该靶点的治疗策略,其偶联的拓扑异构酶I抑制剂与微管蛋白抑制剂无交叉耐药性,为紫杉类化疗失败或传统方案耐药的晚期GC患者提供了新的治疗思路。
研究方法
这是一项在中国19家中心开展的多中心、三阶段Ⅰ期试验,研究依次包括:剂量递增阶段(晚期实体瘤);药代动力学(PK)扩展阶段(晚期实体瘤)和疗效扩展阶段(GC/GEJC),系统评估SHR-A1904的安全性、耐受性及抗肿瘤活性。本文报告GC/GEJC队列在以上三个阶段的安全性、PK、免疫原性及初步疗效数据。
纳入年龄18–75岁、组织学证实的CLDN18.2阳性晚期或转移性实体瘤患者,静脉输注SHR-A1904治疗,每3周一次;剂量递增(0.6 mg/kg起,按i3+3设计递增至10.0 mg/kg);最大耐受剂量(MTD)目标毒性概率为30%(25%–35%视为MTD)。依据剂量递增数据,安全监测委员会(SMC)选定6.0 mg/kg与8.0 mg/kg进行PK及疗效扩展。
研究主要终点包括安全性、剂量限制性毒性(DLT)、MTD及II期推荐剂量(RP2D)。次要终点包括PK特征、免疫原性、客观缓解率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)及OS。
研究结果
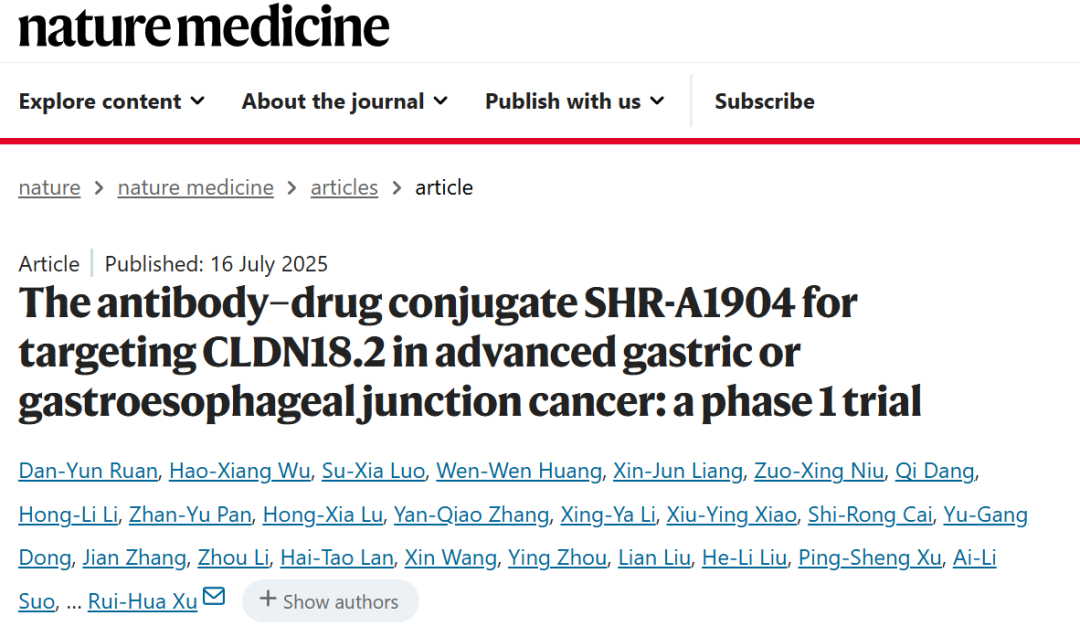
入组患者特征
2019年9月至2024年5月,共95例CLDN18.2阳性晚期GC/GEJC患者入组并接受至少一次SHR-A1904静脉输注治疗。研究阶段分组:剂量递增阶段29例,PK扩展阶段12例,疗效扩展阶段54例(图1)。SHR-A1904注射剂量分组中6.0 mg/kg组35例,8.0 mg/kg组40例(图1)。

图1 患者处置流程
入组患者中位年龄57岁,89.5%为GC,82.1%肿瘤CLDN18.2呈中-高表达(≥50%肿瘤细胞2+/3+),69.5%既往接受过≥2线系统治疗(表1)。至2024年11月1日数据截止,79例(83.2%)已停药,16例仍在治疗。
表1 患者基线信息
安全性与耐受性分析
在剂量递增阶段,3例患者报告了DLT,分别发生在4.8 mg/kg剂量组(3级发热 性中性粒细胞减少、3级血胆红素升高)和6.0 mg/kg剂量组(3级胃黏膜病变)。最高剂量8.0 mg/kg时仍未达到MTD。
性中性粒细胞减少、3级血胆红素升高)和6.0 mg/kg剂量组(3级胃黏膜病变)。最高剂量8.0 mg/kg时仍未达到MTD。
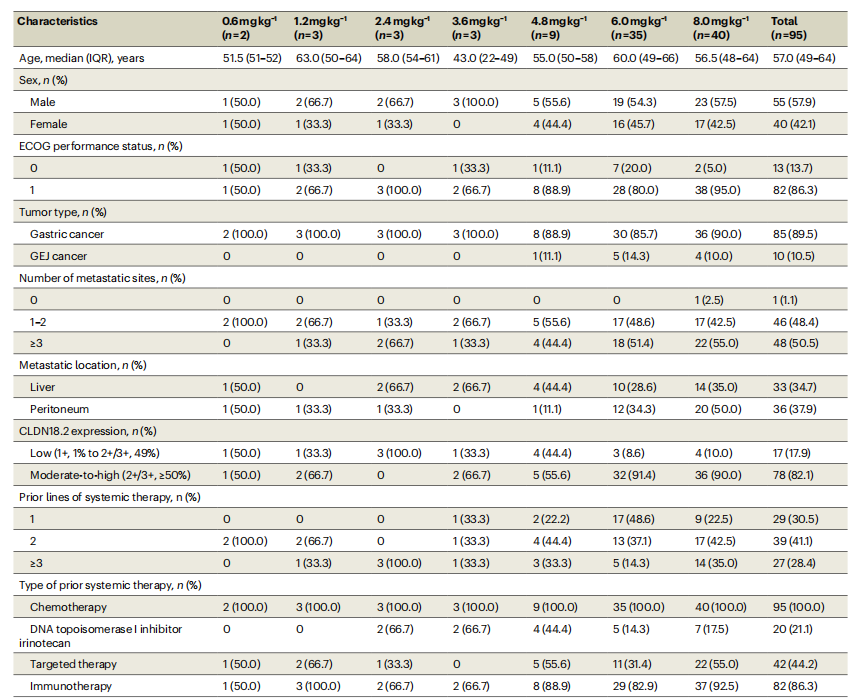
所有患者均出现治疗期间不良事件(TEAE)。最常见的TEAE为贫血 (75.8%)、低白蛋白血症(67.4%)、恶心(64.2%)、白细胞计数降低(58.9%)、中性粒细胞计数降低(56.8%)和呕吐
(75.8%)、低白蛋白血症(67.4%)、恶心(64.2%)、白细胞计数降低(58.9%)、中性粒细胞计数降低(56.8%)和呕吐 (55.8%)(表2)。
(55.8%)(表2)。
表2 治疗期间不良事件
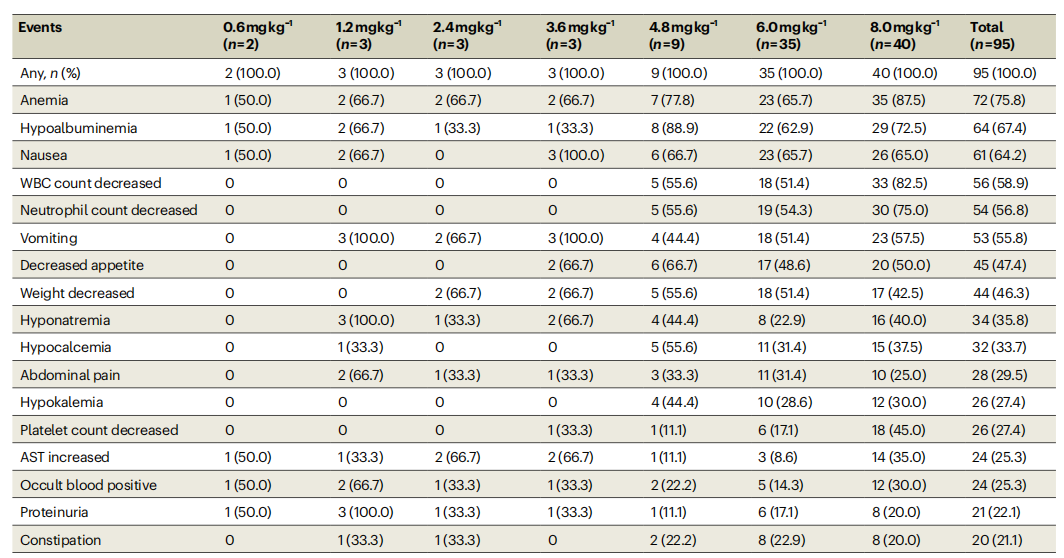
≥3级TEAE发生率为62.1%,主要为贫血(25.3%)、中性粒细胞减少(24.2%)、白细胞减少(23.2%)。58例(61.1%)患者发生严重TEAE,其中42例(44.2%)被认为是治疗相关不良事件(TRAE)且导致治疗中断,13例(13.7%)患者因TRAE导致剂量降低,6例(6.3%)患者因TRAE永久停用SHR-A1904。未发生因TRAE导致的死亡。
在两个选定的剂量水平中,8.0 mg/kg组的安全性较6.0 mg/kg组差,≥3级TEAE(87.5% vs 62.9%)、严重TEAE(72.5% vs 54.3%)、≥3级TRAE(85.0% vs 48.6%)和严重TRAE(62.5% vs 37.1%)的发生率更高。两个剂量组的胃肠道毒性发生率相似,无明显剂量依赖性;6.0 mg/kg组的血液学毒性发生率低于8.0 mg/kg组,支持6.0 mg/kg作为RP2D。
PK分析
41例患者纳入PK分析。SHR-A1904暴露量随剂量(0.6–8.0 mg/kg)呈近似线性增长,半衰期4–7天,轻微蓄积;血浆游离毒素浓度低,表明连接子稳定性良好,减少了系统毒性。
免疫原性
94 例可评估患者中,仅7例(7.4%)出现治疗相关抗药抗体,发生率较低。
疗效分析
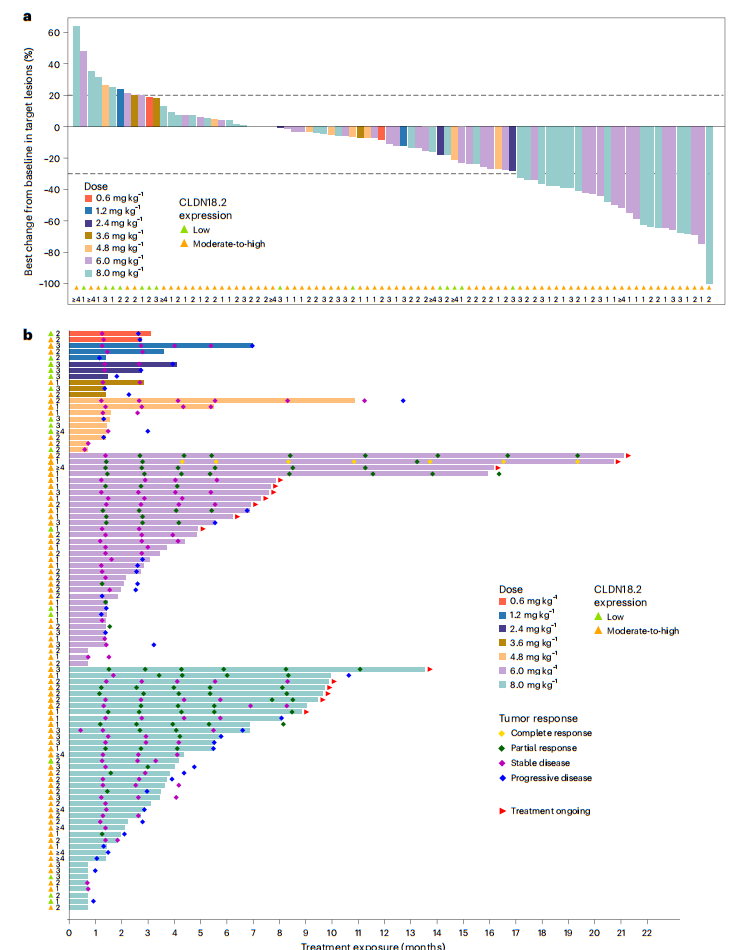
在88例可评估患者中,确认客观缓解率(cORR)为19.3%(95% CI:11.7–29.1),DCR为78.4%(95% CI:68.4–86.5)(图2)。在剂量扩展队列中,6.0 mg/kg组(30 例)的cORR为24.2%(95% CI:11.1–42.3),DCR为87.9%(95% CI:71.8–96.6);8.0 mg/kg组(34 例)的cORR为25.0%(95% CI:12.1–42.2),DCR为80.6%(95% CI:64.0–91.8)。
图2 SHR-A1904的抗肿瘤作用
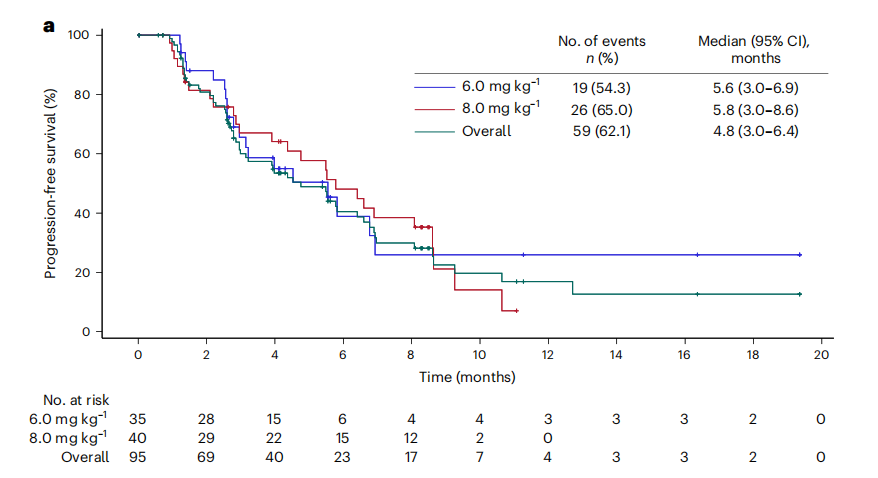
截至数据截止日,95例患者中有59例(62.1%)出现疾病进展或死亡,总体中位PFS为4.8个月(95% CI:3.0–6.4)。其中,6.0 mg/kg 组中位PFS 5.6个月(95% CI:3.0–6.9);8.0 mg/kg 组中位PFS 5.8个月(95% CI:3.0–8.6)(图3)
图3 OS分析
共观察到49例(51.6%)死亡事件。总体6个月OS率为71.9%(95% CI:61.3–80.1),12个月OS率为29.8%(95% CI:17.4–43.2)。6.0 mg/kg组死亡9例(25.7%),6个月OS率76.0%(95% CI:55.8–87.8),12个月OS率63.3%(95% CI:39.3–80.0);8.0 mg/kg 组死亡23例(57.5%),6个月OS率69.5%(95% CI:52.5–81.4),12个月OS率29.4%(95% CI:13.0–47.9)。
研究结论
SHR-A1904在既往经治、CLDN18.2阳性的晚期或转移性GC/GEJC患者中展现出可控的安全性与令人鼓舞的初步疗效。这项研究首次证实,DNA拓扑异构酶I抑制剂载荷的 CLDN18.2靶向ADC具备成为后线治疗新选择的潜力,亦为后续CLDN18.2靶向策略的迭代优化提供了重要循证依据。目前,SHR-A1904单药二线治疗的III期研究(NCT06649292)及联合方案一线治疗的Ib/III期研究(NCT06350006)已相继启动,有望为未来GC精准治疗格局带来突破。

