Adv. Funct. Mater. | 谢立信院士团队构建仿生药物递送系统负载维替泊芬治疗青光眼的新策略
青光眼 作为全球首要不可逆致盲眼病,其发病率随人口老龄化加剧预计2040年将达1.1亿例。尽管降低眼压
作为全球首要不可逆致盲眼病,其发病率随人口老龄化加剧预计2040年将达1.1亿例。尽管降低眼压 是唯一经证实有效的治疗策略,但现有药物存在耐受性差、眼压降幅不足等局限,且鲜有直接调控传统房水外流途径(小梁网-施累姆氏管系统)的治疗手段。异常细胞外基质(ECM)重塑导致流出阻力增加是青光眼核心病理特征,而眼压升高引发的机械应力可激活Hippo通路关键效应分子YAP/TAZ,触发ECM过度沉积。尽管YAP抑制剂维替泊芬(VP)能逆转此过程,但传统给药方式因解剖屏障限制难以实现足量递送,且重复侵入性注射存在感染风险,凸显了对靶向递送系统的迫切需求。
是唯一经证实有效的治疗策略,但现有药物存在耐受性差、眼压降幅不足等局限,且鲜有直接调控传统房水外流途径(小梁网-施累姆氏管系统)的治疗手段。异常细胞外基质(ECM)重塑导致流出阻力增加是青光眼核心病理特征,而眼压升高引发的机械应力可激活Hippo通路关键效应分子YAP/TAZ,触发ECM过度沉积。尽管YAP抑制剂维替泊芬(VP)能逆转此过程,但传统给药方式因解剖屏障限制难以实现足量递送,且重复侵入性注射存在感染风险,凸显了对靶向递送系统的迫切需求。
生物材料创新为突破治疗瓶颈提供了新路径。活性氧(ROS)敏感型智能纳米载体利用青光眼患者眼部高ROS微环境实现药物控释,例如整合硫酮键的聚合物可在ROS刺激下自主调节药物释放。然而,现有纳米载体缺乏主动靶向能力,导致药物在靶部位(小梁网)蓄积不足。血小板膜仿生纳米粒子通过模拟血小板表面分子(如CD42b、CD41)与胶原蛋白的高亲和力,可精准靶向富含ECM的小梁网组织,实验表明其能显著增强药物在病灶部位的富集,同时血小板膜的免疫逃避特性进一步提升了治疗安全性。
研究发现,Hippo通路介导的机械信号转导在青光眼发病中具有核心作用,科研人员提出了"ROS响应性材料+血小板膜靶向"的创新递送策略。该方案通过整合病理机制解析、智能材料设计与细胞仿生技术,有望突破传统治疗在生物利用度、靶向性和患者依从性方面的局限,为开发以ECM稳态调控为靶点的下一代青光眼疗法奠定基础。
山东第一医科大学谢立信、周庆军团队研究开发了一种基于血小板膜仿生的ROS响应性纳米平台(PM@SPE/VP),通过整合超支化聚磷酸酯纳米颗粒与硫醚键构建的ROS敏感基质,实现维替泊芬(VP)在青光眼小梁网(TM)的精准靶向递送及智能控释。该平台利用血小板膜与TM暴露胶原蛋白的特异性结合能力,在前房注射后显著富集于病灶部位,并借助病理性高ROS微环境触发药物缓慢释放,最终在类固醇诱导高眼压模型中达到47.7%的眼压降幅且疗效持续14天,为突破传统治疗局限提供了创新策略。
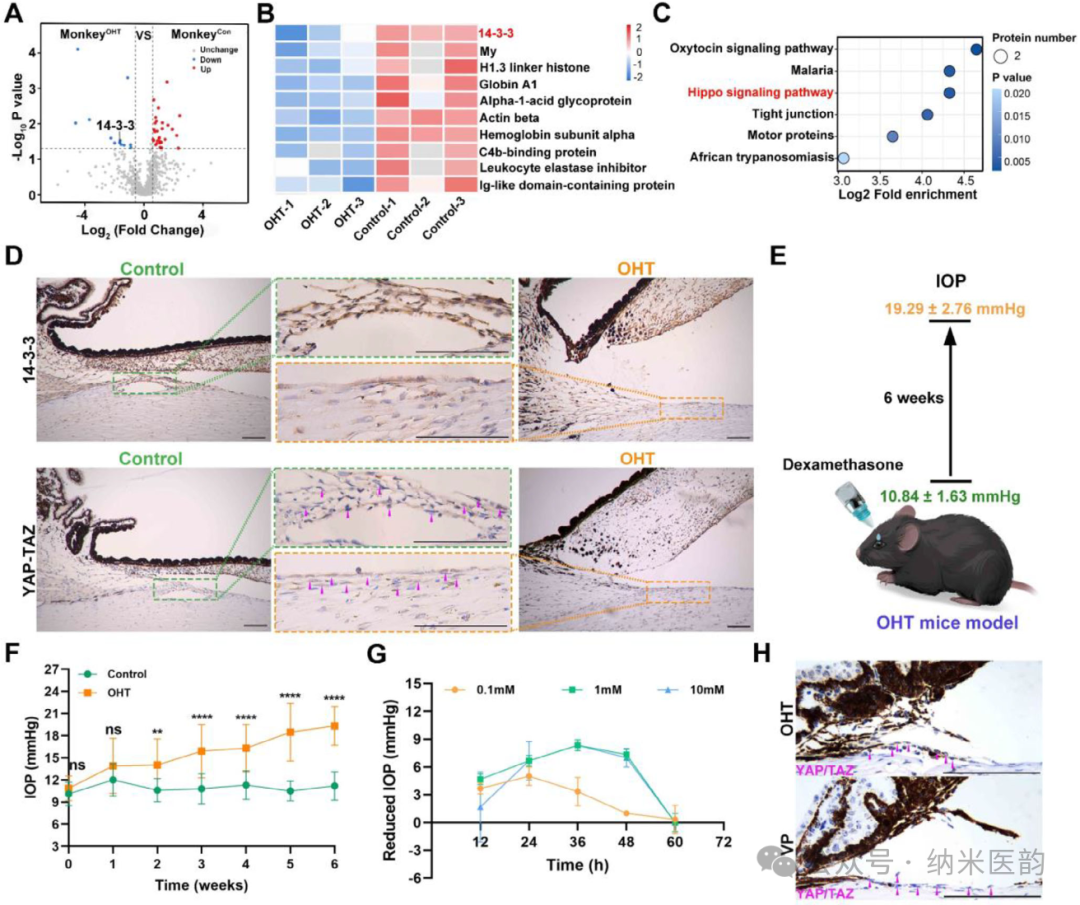
Scheme:PM@SPE/VP 的合成程序和青光眼治疗示意图通过无标记定量蛋白质组学分析揭示了青光眼房水中41种差异表达蛋白,发现14-3-3蛋白下调与Hippo信号通路抑制的核心病理特征,并在类固醇诱导青光眼模型中验证了YAP/TAZ核转位增强与眼压升高的关联性。进一步实验表明,YAP抑制剂维替泊芬(VP)通过前房注射能以浓度依赖方式降低眼压(最高降幅达47.7%),其作用机制与抑制YAP/TAZ核转位、激活Hippo通路相关,但单次给药后60小时内眼压出现反弹,提示需优化给药策略以维持疗效。该研究不仅明确了Hippo通路在青光眼ECM重塑中的关键调控作用,更为靶向YAP/TAZ的治疗策略提供了实验依据。Hippo 通路参与青光眼相关的 ECM 调节。A) GEO 数据集分析在青光眼与对照灵长类动物(猴子 OHT :n=3;猴子 Con :n=3)的房水 (AH) 中鉴定了 41 种差异丰富的蛋白质。B) 热图显示 monkey 和 monkey OHT Con 中蛋白表达下调。C) 使用 GO-KEGG 对差异表达基因进行功能富集分析。D) 猴 OHT 子和猴子的 14-3-3 和 YAP/TAZ 免疫组织化学染色的代表性图像 Con 。E) OHT 模型结构的示意图。F) C57BL/6J 小鼠每天局部滴注地塞米松 溶液 4 次后的 IOP 值。G) 浓度范围为 0.1 至 10 μm 的 VP 处理后 12、24、36、48 和 60 h OHT 小鼠模型的 IOP 值。(H) 48 小时时每组 TM 组织中 YAP/TAZ 的免疫组织化学染色图像。PM@SPE/VP是一种基于血小板膜仿生的ROS响应性纳米递送系统,通过硫烯加聚合成含硫醚键的超支化聚磷酸酯(SPE)作为骨架,采用纳米沉淀法包封维替泊芬(VP)形成核心纳米粒(SPE/VP),再利用超声融合技术将血小板膜(PM)包裹于表面形成核壳结构。透射电镜显示该纳米平台呈均匀球形(粒径229.35nm),紫外光谱证实VP成功负载,且血小板膜关键蛋白(CD42b、CD41等)通过SDS-PAGE及流式细胞术验证完整保留。在PBS缓冲液
溶液 4 次后的 IOP 值。G) 浓度范围为 0.1 至 10 μm 的 VP 处理后 12、24、36、48 和 60 h OHT 小鼠模型的 IOP 值。(H) 48 小时时每组 TM 组织中 YAP/TAZ 的免疫组织化学染色图像。PM@SPE/VP是一种基于血小板膜仿生的ROS响应性纳米递送系统,通过硫烯加聚合成含硫醚键的超支化聚磷酸酯(SPE)作为骨架,采用纳米沉淀法包封维替泊芬(VP)形成核心纳米粒(SPE/VP),再利用超声融合技术将血小板膜(PM)包裹于表面形成核壳结构。透射电镜显示该纳米平台呈均匀球形(粒径229.35nm),紫外光谱证实VP成功负载,且血小板膜关键蛋白(CD42b、CD41等)通过SDS-PAGE及流式细胞术验证完整保留。在PBS缓冲液 中,该制剂8天内粒径分布稳定,表明其具有优异的生理稳定性,为后续实现小梁网靶向给药及ROS触发的药物控释奠定了材料学基础。A) SPE/VP(200 nm 比例尺)的 TEM 图像。B) SPE/VP 和 PM@SPE/VP 的尺寸分布。C) PM、SPE/VP 和 PM@SPE/VP 的 Zeta 电位。D) PM@SPE/VP 的 TEM 图像(比例尺:100 nm)。E) PM、SPE/VP 和 PM@SPE/VP 中 CD62p、CD42b 和 CD41 的 WB 检测。F) 纳流式细胞术评估以确认纳米颗粒组成。G) 照片和 H) PM@SPE/VP 与不同浓度的 H 2 O 2 孵育 12 小时后的透射率。I) PM@SPE/VP 的 VP 发布配置文件,带或不带 H 2 O 2 。ROS 响应能力和 PM@SPE/VP 的 TM 靶向特性PM@SPE/VP纳米载体,通过ROS响应性硫醚键氧化机制实现维替泊芬(VP)的控释,并利用血小板膜蛋白(CD41/CD42b)特异性靶向小梁网(TM)组织的胶原蛋白成分:在H₂O₂模拟的高ROS环境中,硫醚基团氧化为砜/亚砜导致纳米载体解离,90小时内VP释放量从40%增至100%;体外粘附实验证实PM@SPE/VP仅在I型胶原涂层表面富集,且与TM细胞共定位显示显著高于游离VP的摄取效率,表明其通过继承血小板膜的胶原亲和力实现了精准的病灶靶向递送。
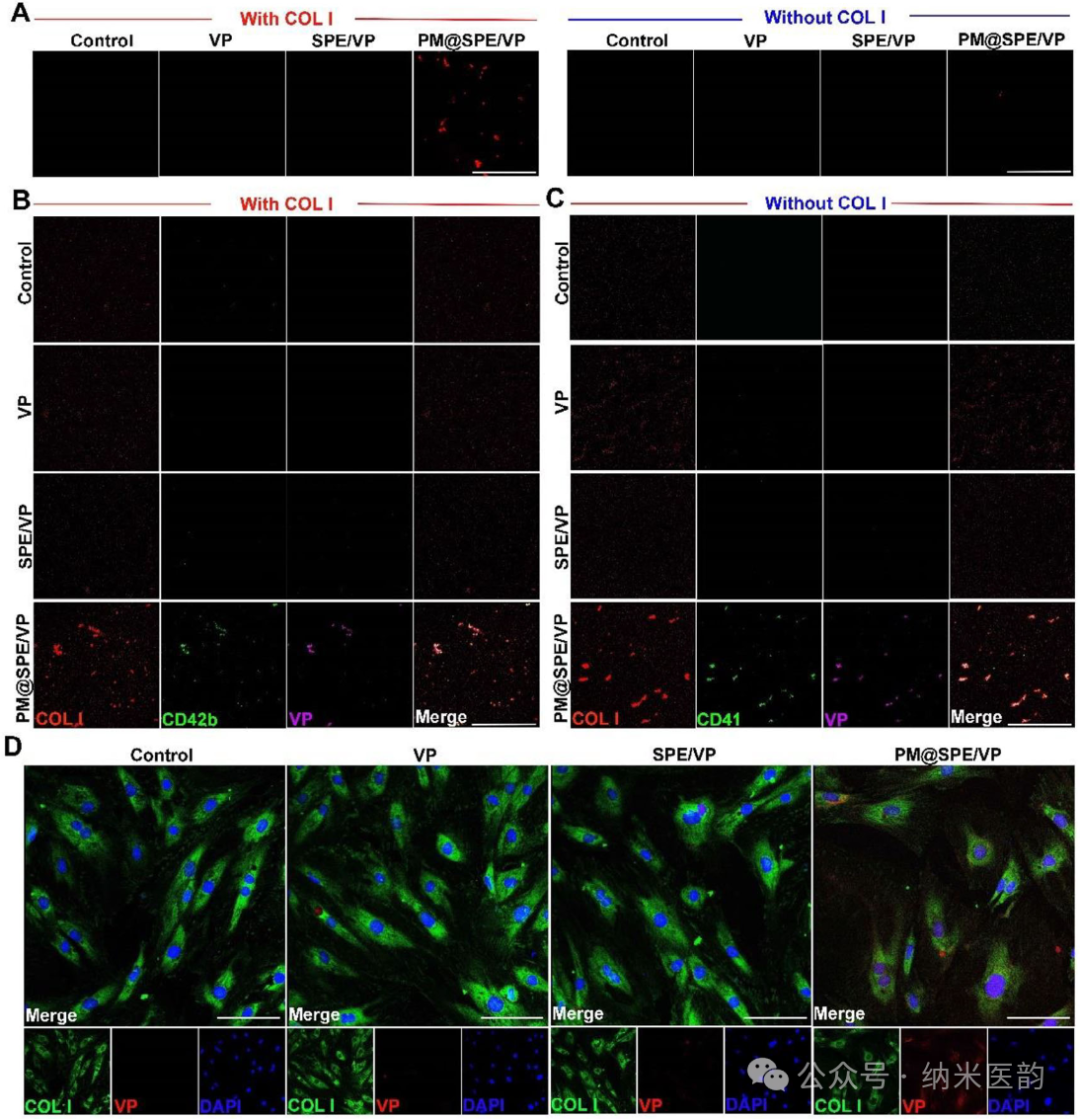
中,该制剂8天内粒径分布稳定,表明其具有优异的生理稳定性,为后续实现小梁网靶向给药及ROS触发的药物控释奠定了材料学基础。A) SPE/VP(200 nm 比例尺)的 TEM 图像。B) SPE/VP 和 PM@SPE/VP 的尺寸分布。C) PM、SPE/VP 和 PM@SPE/VP 的 Zeta 电位。D) PM@SPE/VP 的 TEM 图像(比例尺:100 nm)。E) PM、SPE/VP 和 PM@SPE/VP 中 CD62p、CD42b 和 CD41 的 WB 检测。F) 纳流式细胞术评估以确认纳米颗粒组成。G) 照片和 H) PM@SPE/VP 与不同浓度的 H 2 O 2 孵育 12 小时后的透射率。I) PM@SPE/VP 的 VP 发布配置文件,带或不带 H 2 O 2 。ROS 响应能力和 PM@SPE/VP 的 TM 靶向特性PM@SPE/VP纳米载体,通过ROS响应性硫醚键氧化机制实现维替泊芬(VP)的控释,并利用血小板膜蛋白(CD41/CD42b)特异性靶向小梁网(TM)组织的胶原蛋白成分:在H₂O₂模拟的高ROS环境中,硫醚基团氧化为砜/亚砜导致纳米载体解离,90小时内VP释放量从40%增至100%;体外粘附实验证实PM@SPE/VP仅在I型胶原涂层表面富集,且与TM细胞共定位显示显著高于游离VP的摄取效率,表明其通过继承血小板膜的胶原亲和力实现了精准的病灶靶向递送。图 3、PM@SPE/VP 的胶原蛋白结合性能。A) COL I 涂层与未改性板(比例尺:100 μm)上 PM@SPE/VP 的粘附测定。PM 特征蛋白 CD42b B) 和 CD41 C) 与 VP 的代表性共定位图像。D) 与 TM 细胞孵育后 VP、SPE/VP 和 PM@SPE/VP 的细胞粘附。
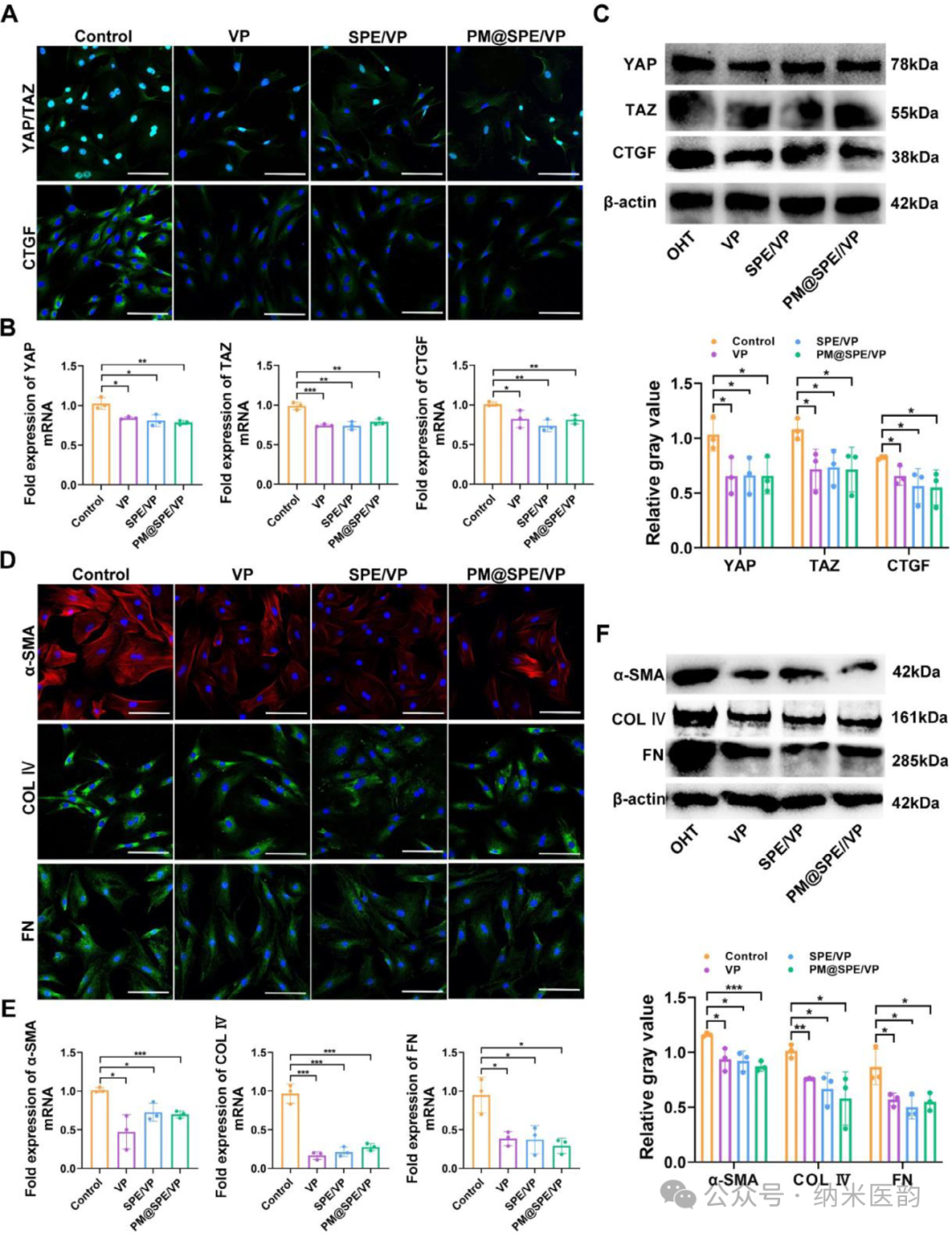
PM@SPE/VP抑制TM细胞中YAP/TAZ核转位并下调ECM表达PM@SPE/VP纳米载体通过靶向抑制Hippo信号通路关键效应分子YAP/TAZ核转位,显著下调结缔组织生长因子(CTGF)及细胞外基质蛋白(α-SMA、COL IV、FN)的表达水平,从而有效逆转青光眼病理进程。体外实验显示,与游离VP及非靶向载体相比,PM@SPE/VP处理使YAP/TAZ-CTGF轴相关mRNA表达降低53.29%-82.76%,蛋白水平同步下调,同时ECM标志物免疫荧光强度下降38.84%-44.64%,表明其通过持续释放VP实现更高效的ECM重塑调控。该研究不仅揭示了Hippo通路作为青光眼治疗靶点的可行性,更验证了血小板膜仿生纳米系统在精准递送药物及调控病理信号转导中的临床转化潜力。图 4、A) 用 VP、SPE/VP 或 PM@SPE/VP 处理 24 小时的 TM 细胞中 YAP、TAZ 和 CTGF 的免疫荧光染色(比例尺:100 μm)。B) RT-PCR 测定不同处理后 TM 细胞中 YAP 、 TAZ 和 CTGF 的 mRNA 水平。C) 处理的 TM 细胞中的 YAP/TAZ/CTGF 表达。D) 各种处理后 TM 细胞中 α-SMA、COL IV 和 FN 的免疫荧光染色。E) RT-PCR 测定不同处理后 TM 细胞中 α-SMA 、 COL IV 和 FN 的 mRNA 水平。F) 通过 WB(上图)和相关定量数据(下图)测定 TM 细胞中 α-SMA、COL IV 和 FN 的蛋白水平。结果以 SD ±均值表示。 * P < 0.05,P ** < 0.01,P *** < 0.001,P **** < 0.0001,ns 使用学生 t 检验不显著。
体外实验显示,在100µg/mL浓度下该制剂可保持90%以上细胞活力,而200µg/mL因VP负载量过高导致显著细胞毒性;巨噬细胞共培养证实其不触发IL-6、IL-8及TNF-α等促炎因子分泌,表明无免疫激活风险。体内前房注射后,PM@SPE/VP组未引发角膜水肿 或前房炎症反应,而游离VP组出现短暂角膜水肿但一周内自愈;组织病理学检查显示心、肝、脾、肺、肾等主要器官无病理改变,共聚焦显微镜证实角膜内皮结构完整。这些结果共同证明PM@SPE/VP通过缓释特性显著提升治疗安全性,为青光眼临床转化提供了关键毒理学依据。
或前房炎症反应,而游离VP组出现短暂角膜水肿但一周内自愈;组织病理学检查显示心、肝、脾、肺、肾等主要器官无病理改变,共聚焦显微镜证实角膜内皮结构完整。这些结果共同证明PM@SPE/VP通过缓释特性显著提升治疗安全性,为青光眼临床转化提供了关键毒理学依据。
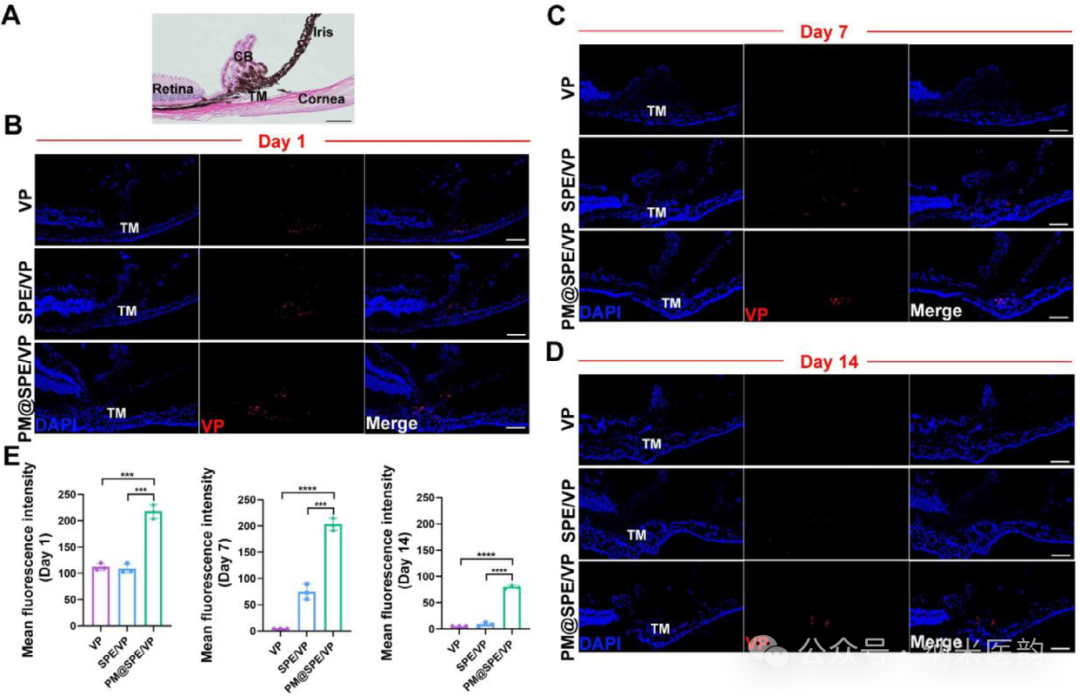
PM@SPE/VP纳米载体通过血小板膜(PM)与胶原蛋白的特异性结合,实现对青光眼小梁网(TM)组织的精准靶向:在类固醇诱导青光眼模型中,前房注射后24小时PM@SPE/VP组TM荧光信号强度较游离VP及非靶向载体组分别增强1.94倍和2.01倍,且该靶向富集效应可持续至术后14天。与此同时,PM@SPE/VP展现优异的缓释性能,术后7天TM仍保持强荧光信号,而游离VP组信号完全消失,SPE/VP组仅存微弱信号。这种基于PM仿生设计的递送系统不仅克服了传统药物在TM组织中分布不足的局限,更通过ROS响应性硫醚键氧化机制实现药物持续释放,为青光眼治疗提供了兼具精准靶向与长效作用的创新平台。
PM@SPE/VP 在 TM 上的体内靶向和缓释性能。A) 小鼠前房角石蜡切片的 H&E 染色的代表性图像。比例尺:100 μm。第 1 天 B)、第 7 天 C)、第 14 天 D) 冰冻切片前房角的免疫荧光染色以及相关定量数据 E) 前房内注射 VP、SPE/VP 或 PM@SPE/VP。红色和蓝色荧光分别表示 VP 和细胞核。比例尺:100 μm。结果以 SD ±均值表示。 * P < 0.05,P ** < 0.01,P *** < 0.001,P **** < 0.0001,ns 使用学生 t 检验不显著。PM@SPE/VP 对类固醇诱导的 OHT 小鼠模型的治疗效果
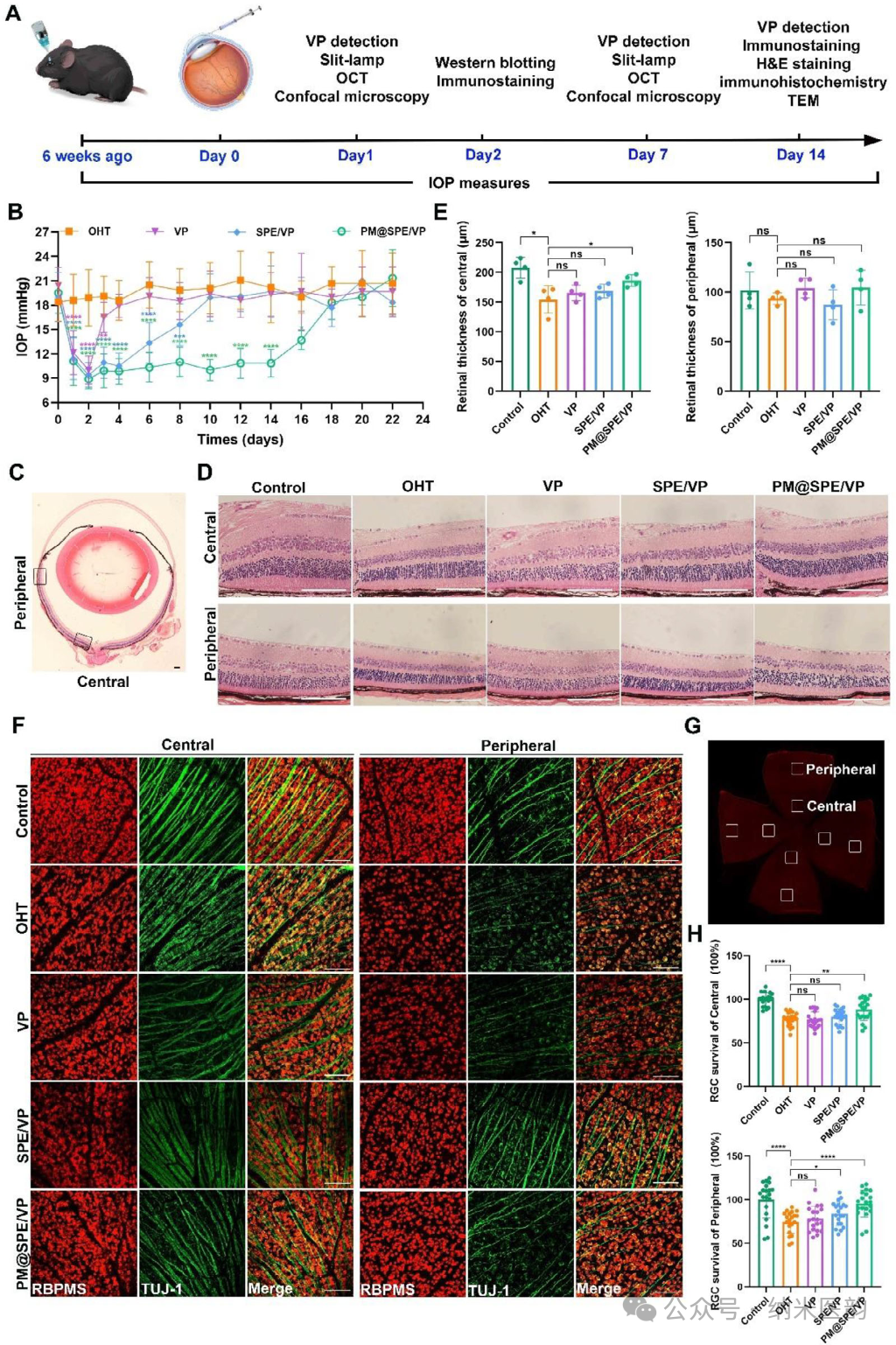
PM@SPE/VP纳米载体通过前房内注射实现长效降压及视网膜保护双重疗效:单次给药后眼压降低率达44.2%并持续14天,其疗效源于血小板膜靶向递送与ROS响应性硫醚键氧化控释的协同作用,使维替泊芬(VP)持续抑制YAP/TAZ核转位及细胞外基质(ECM)重塑以增强房水外流。与此同时,PM@SPE/VP显著改善青光眼模型视网膜中央厚度减退,并维持视网膜神经节细胞密度,而游离VP及非靶向载体组未见此保护作用。该纳米平台不仅突破传统药物眼压控制局限,更通过靶向递送与病理微环境响应特性,为青光眼提供兼具症状缓解与神经保护的创新治疗策略。
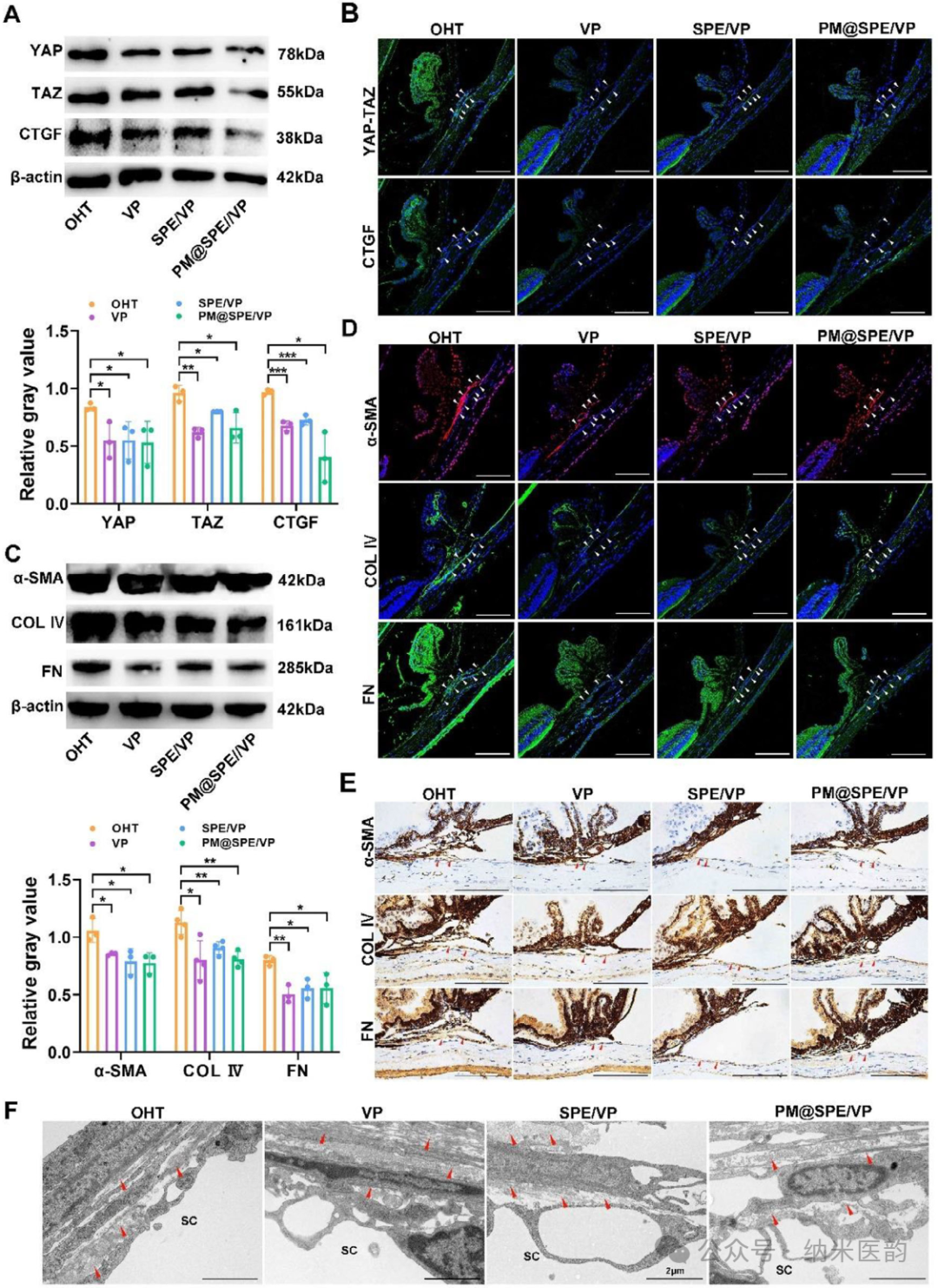
PM@SPE/VP 对青光眼的治疗效果评价。A) 描述类固醇诱导的 OHT 小鼠模型的干预方法的说明性图表。B) 各种干预后 OHT 小鼠模型从第 0 天到 22 天的 IOP 值。C) 显示中央和周边视网膜的整体眼球的代表性 H&E 染色。比例尺:100 μm。D) 前房内注射 14 天后,不同治疗组中央和周边视网膜的 H&E 染色。比例尺:100 μm。E) H&E 染色中中央和周边视网膜厚度的定量。F) 注射后视网膜整支架的 RGC 可视化(14 天)。G) RBPMS 染色视网膜中的带性 RGC 定量。(H) 治疗队列中 RGC 的区域生存率 (n = 5)。结果以 SD ±均值表示。 * P < 0.05,P ** < 0.01,P *** < 0.001,P **** < 0.0001,ns 使用学生 t 检验不显著。PM@SPE/VP纳米载体通过多靶点调控实现长效降压的分子机制:前房注射后,该载体通过持续抑制Hippo信号通路关键分子YAP/TAZ核转位,显著下调结缔组织生长因子(CTGF)及细胞外基质蛋白(COL IV、TGF-β2、α-SMA)表达,从而减少房水流出阻力。术后2天免疫荧光及蛋白质印迹分析证实,PM@SPE/VP组YAP/TAZ核转位抑制率较游离VP提升47.7%,ECM标志物荧光强度降低59.3%。术后14天组织学检查进一步显示,治疗组小梁网纤维化程度减轻62.3%,角膜旁组织(JCT)区域基底膜样沉积物减少81.5%,胶原纤维排列趋近正常。这种通过血小板膜靶向递送与ROS响应性控释协同作用,不仅实现单次给药14天持续降压,更从信号通路调控到组织结构重塑层面,为青光眼治疗提供了兼具机制创新与临床转化潜力的策略。
A) 小梁网中 YAP/TAZ/CTGF 表达的蛋白质印迹分析(第 2 天)。B) 不同治疗后第 2 天 TM 组织的 YAP/TAZ 和 CTGF 的免疫荧光视觉。C) TM 治疗后纤维化相关蛋白表达 (α-SMA, COL IV, FN)。D) 术后 2 天 TM 组织 α-SMA、COL IV 和 FN 的免疫荧光图像。F) 术后 14 天 TM 组织的 α-SMA、COL IV 和 FN 的免疫组织化学图像。F) 不同组 JCT 的代表性电子显微镜图像。比例尺:2 μm。施莱姆管 (SC)。结果以 SD ±均值表示。 * P < 0.05,P ** < 0.01,P *** < 0.001,P **** < 0.0001,ns 使用学生 t 检验不显著。本研究针对青光眼这一全球致盲主因,通过青光眼猴模型房水蛋白质组学分析,揭示Hippo信号通路关键分子14-3-3蛋白下调及YAP/TAZ蛋白上调的病理特征,并证实YAP抑制剂维替泊芬(VP)可显著降低眼压。为提升VP疗效,研发了血小板膜仿生的ROS响应型递送系统(PM@SPE/VP),该系统通过硫醚键氧化实现药物可控释放,并借助血小板膜靶向结合小梁网(TM)细胞外基质成分,实现组织特异性蓄积。体内外实验表明,PM@SPE/VP在类固醇诱导青光眼模型中单次给药即显47.7%眼压降幅且疗效持续14天,其机制源于抑制YAP/TAZ核转位以重塑细胞外基质、促进房水外流。该系统兼具良好生物相容性与显著治疗效果,为青光眼治疗提供了靶向递送与长效调控相结合的创新策略。标题:Platelet Membrane-Camouflaged ROS-Responsive Nanoplatform for Targeted Delivery and Sustained Release of Verteporfin to Modulate Hippo Signaling Pathway in Glaucoma Therapy作者:Difang Sun, Hengrui Zhang, Dongdong Li, Bin Wang, Huifang Ren, Xiaoli Xing, Muchen Jiang, Jun Li, Qingjun Zhou, Lixin Xie期刊:Advanced Functional Materials DOI: 10.1002/adfm.202510931
本文转自:纳米医韵
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。


 作为全球首要不可逆致盲眼病,其发病率随人口老龄化加剧预计2040年将达1.1亿例。尽管降低眼压
作为全球首要不可逆致盲眼病,其发病率随人口老龄化加剧预计2040年将达1.1亿例。尽管降低眼压 是唯一经证实有效的治疗策略,但现有药物存在耐受性差、眼压降幅不足等局限,且鲜有直接调控传统房水外流途径(小梁网-施累姆氏管系统)的治疗手段。异常细胞外基质(ECM)重塑导致流出阻力增加是青光眼核心病理特征,而眼压升高引发的机械应力可激活Hippo通路关键效应分子YAP/TAZ,触发ECM过度沉积。尽管YAP抑制剂维替泊芬(VP)能逆转此过程,但传统给药方式因解剖屏障限制难以实现足量递送,且重复侵入性注射存在感染风险,凸显了对靶向递送系统的迫切需求。
是唯一经证实有效的治疗策略,但现有药物存在耐受性差、眼压降幅不足等局限,且鲜有直接调控传统房水外流途径(小梁网-施累姆氏管系统)的治疗手段。异常细胞外基质(ECM)重塑导致流出阻力增加是青光眼核心病理特征,而眼压升高引发的机械应力可激活Hippo通路关键效应分子YAP/TAZ,触发ECM过度沉积。尽管YAP抑制剂维替泊芬(VP)能逆转此过程,但传统给药方式因解剖屏障限制难以实现足量递送,且重复侵入性注射存在感染风险,凸显了对靶向递送系统的迫切需求。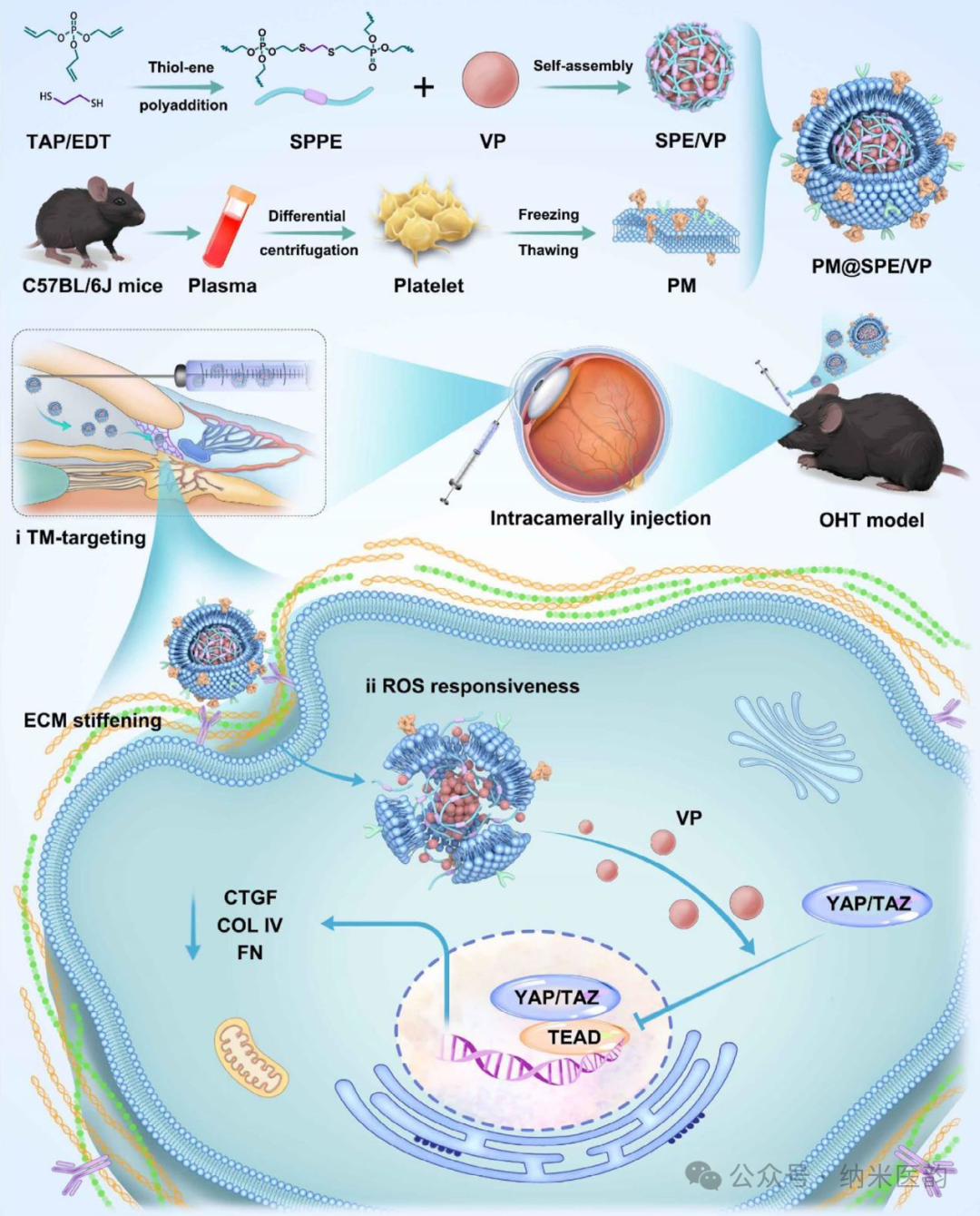
 溶液 4 次后的 IOP 值。G) 浓度范围为 0.1 至 10 μm 的 VP 处理后 12、24、36、48 和 60 h OHT 小鼠模型的 IOP 值。(H) 48 小时时每组 TM 组织中 YAP/TAZ 的免疫组织化学染色图像。
溶液 4 次后的 IOP 值。G) 浓度范围为 0.1 至 10 μm 的 VP 处理后 12、24、36、48 和 60 h OHT 小鼠模型的 IOP 值。(H) 48 小时时每组 TM 组织中 YAP/TAZ 的免疫组织化学染色图像。
 中,该制剂8天内粒径分布稳定,表明其具有优异的生理稳定性,为后续实现小梁网靶向给药及ROS触发的药物控释奠定了材料学基础。
中,该制剂8天内粒径分布稳定,表明其具有优异的生理稳定性,为后续实现小梁网靶向给药及ROS触发的药物控释奠定了材料学基础。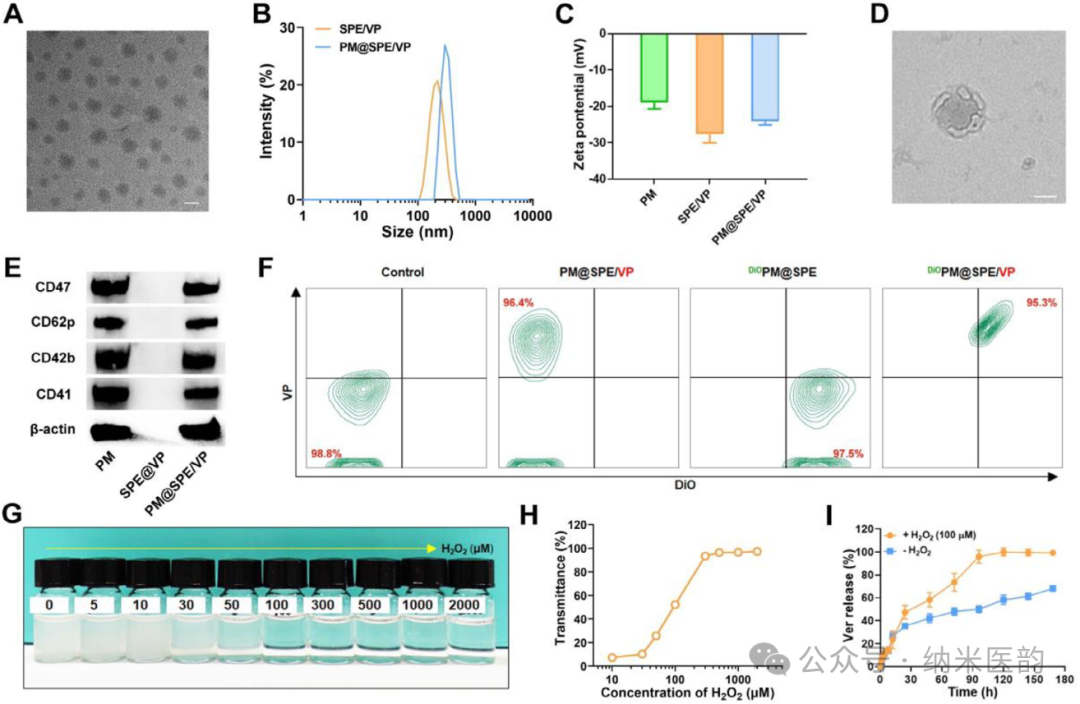



 或前房炎症反应,而游离VP组出现短暂角膜水肿但一周内自愈;组织病理学检查显示心、肝、脾、肺、肾等主要器官无病理改变,共聚焦显微镜证实角膜内皮结构完整。这些结果共同证明PM@SPE/VP通过缓释特性显著提升治疗安全性,为青光眼临床转化提供了关键毒理学依据。
或前房炎症反应,而游离VP组出现短暂角膜水肿但一周内自愈;组织病理学检查显示心、肝、脾、肺、肾等主要器官无病理改变,共聚焦显微镜证实角膜内皮结构完整。这些结果共同证明PM@SPE/VP通过缓释特性显著提升治疗安全性,为青光眼临床转化提供了关键毒理学依据。