
王贵强教授:乙肝相关肝癌疾病负担及治疗进展——中国实践助力消除肝炎危害
医脉通编辑整理,未经授权请勿转载。
导语
近日,2025年世界肝炎日宣传大会暨第七届慢乙肝临床治愈学术大会在北京圆满举办!肝病领域专家学者共聚一堂,围绕慢乙肝临床治愈的最新研究进展及热点议题展开深度交流与精彩分享,携手见证慢乙肝临床治愈的全新阶段。
大会上,北京大学第一医院王贵强教授就“乙肝相关肝癌疾病负担及治疗进展:中国实践助力消除肝炎危害”这一主题进行了精彩演讲,医脉通对主要内容进行整理,以飨读者。
我国肝癌疾病负担沉重,肝癌发病及死亡人数占全球40%以上。2022年,全球肝癌的新发人数为86.5万(位居第6位),死亡人数为75.8万(高居第3位)。我国肝癌的新发人数为36.8万(位居第4位),死亡人数为31.7万(位居第2位),均占全球近一半。
全球肝细胞癌 (HCC)主要病因包括病毒感染、代谢性肝病、酒精性肝病
(HCC)主要病因包括病毒感染、代谢性肝病、酒精性肝病 。在亚洲及非洲大部分地区,病毒性肝炎
。在亚洲及非洲大部分地区,病毒性肝炎 是HCC的主要致病因素;而在北美、欧洲、拉丁美洲和澳大拉西亚地区,非病毒性因素(如代谢相关脂肪性肝病和酒精性肝病)则是HCC的主要病因。而在我国肝癌的主要病因是慢性乙型肝炎(HBV)感染,超80%HCC是由HBV感染所致。因多数患者肝癌发现较晚,确诊时已中晚期,错过最佳治疗时机。我国肝癌生存率低,肝癌5年生存率仅12.1%,国家和患者的经济负担都相对沉重。
是HCC的主要致病因素;而在北美、欧洲、拉丁美洲和澳大拉西亚地区,非病毒性因素(如代谢相关脂肪性肝病和酒精性肝病)则是HCC的主要病因。而在我国肝癌的主要病因是慢性乙型肝炎(HBV)感染,超80%HCC是由HBV感染所致。因多数患者肝癌发现较晚,确诊时已中晚期,错过最佳治疗时机。我国肝癌生存率低,肝癌5年生存率仅12.1%,国家和患者的经济负担都相对沉重。
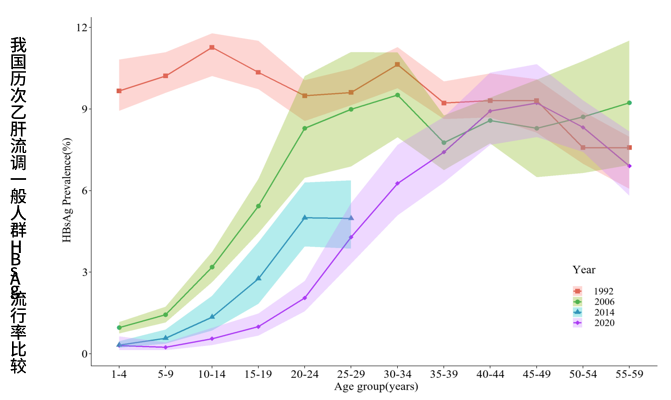
根据最新统计2020 年全国有约7500万人慢性HBV感染者,乙肝诊断率和治疗率分别仅有22%和15%,大量患者在疾病进展前未得到及时诊疗,未来面临巨大肝硬化 和肝癌风险。
和肝癌风险。
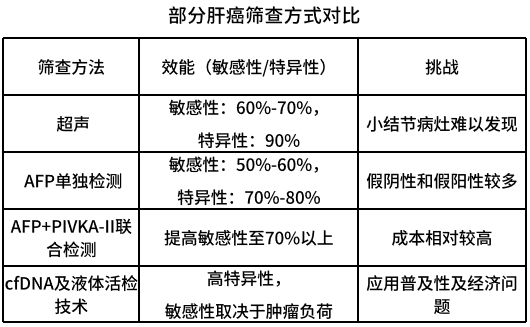
肝癌筛查的主要方法包括:血清学检测(如甲胎蛋白、异常凝血酶原)、影像学检查(如超声、CT/MRI)以及一些新兴检测技术(如液体活检),由于技术局限性、医疗理念及成本等问题,也给肝癌的早期发现带来一定的困难。超50%的肝癌新发患者处于进展期和终末期。故亟需开发并转化更早期、更敏感的筛查手段。
HCC患者确诊时机可影响治疗时机。晚期HCC,如伴多发灶或远端转移患者常丧失手术机会。由于肝癌起病隐匿,首次诊断时只有不到30%的肝癌患者适合接受根治性治疗。各指南均强调HCC早诊早治的重要性。未来需进一步突破现有筛查局限,提高早诊早治水平。
而肝癌根治性切除术后复发问题也让肝癌患者长期生存面临挑战,数据显示,切除术后5年复发率高达40-60%以上。术后复发包括早期复发和晚期复发,通常认为术后2年内的复发属于早期复发,2年及之后的复发为晚期复发。前者的危险因素包括肿瘤多发、肿瘤长径>5cm、肿瘤分化差(Edmondson Ⅲ~Ⅳ级)、微血管或大血管侵犯、淋巴结转移、切缘≤1cm、肿瘤标志物 [AFP和(或)异常凝血酶原(des-gamma carboxyprothrombin,DCP)]持续异常等;后者的危险因素包括年龄>60岁、慢性病毒性肝炎活动期、HBVDNA>106拷贝/mL、HBsAg阳性、肝硬化程度、Ishak评分>6分或Scheuer>4分、低白蛋白血症、多发肿瘤等。
[AFP和(或)异常凝血酶原(des-gamma carboxyprothrombin,DCP)]持续异常等;后者的危险因素包括年龄>60岁、慢性病毒性肝炎活动期、HBVDNA>106拷贝/mL、HBsAg阳性、肝硬化程度、Ishak评分>6分或Scheuer>4分、低白蛋白血症、多发肿瘤等。
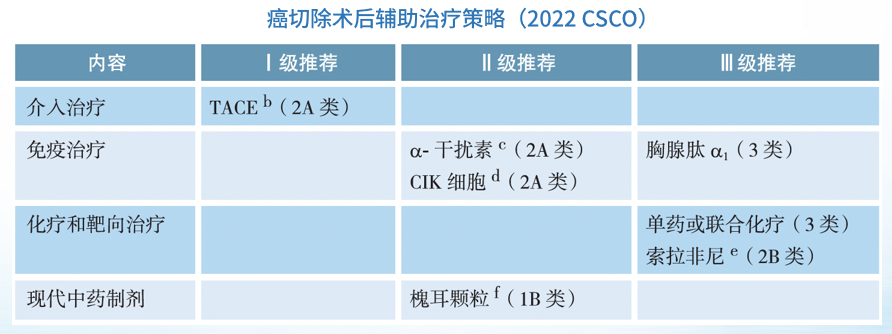
对于适合手术切除同时具有术后高危复发转移风险的肝癌患者,术后可采取抗病毒、经动脉化疗栓塞(TACE)、肝动脉灌注化疗(HAIC)、放射治疗 、系统抗肿瘤治疗等辅助治疗以降低术后复发转移率,延长生存时间。现阶段尚无全球公认的肝癌术后辅助治疗方案,有关大型临床研究正在进行之中。
、系统抗肿瘤治疗等辅助治疗以降低术后复发转移率,延长生存时间。现阶段尚无全球公认的肝癌术后辅助治疗方案,有关大型临床研究正在进行之中。
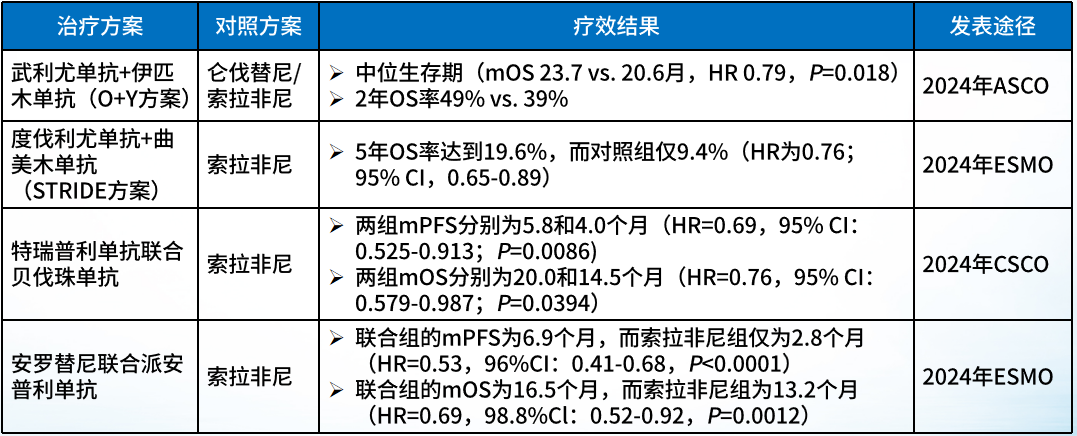
晚期肝癌治疗进展迅速,联合治疗的方案越来越成熟
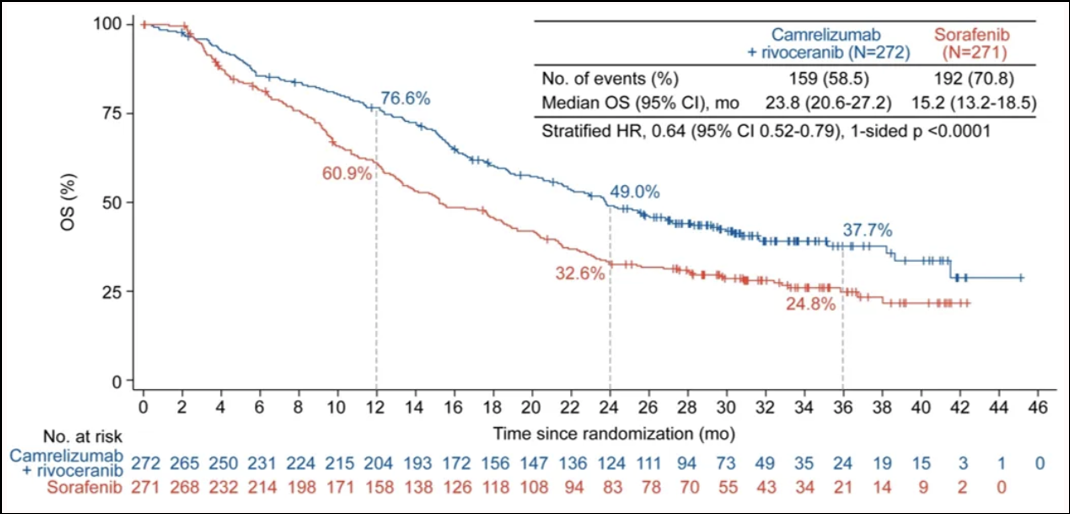
CARES-310研究为一项前瞻性、随机、平行、对照开放标签的国际多中心的III期临床研究,观察评估卡瑞利珠单抗 联合阿帕替尼
联合阿帕替尼 (“双艾”方案)对比索拉非尼
(“双艾”方案)对比索拉非尼 治疗既往未接受过系统治疗的不可切除或转移性HCC患者的有效性和安全性。2024年ASCO年会上,进一步公布了该研究的最终分析结果数据,“双艾”联合组的mOS为23.8个月,而索拉非尼组仅为15.2个月;(HR=0.64,单侧P<0.0001);同时,2年OS率分别为49.0%和32.6%,3年OS率分别为37.7%和24.8%。
治疗既往未接受过系统治疗的不可切除或转移性HCC患者的有效性和安全性。2024年ASCO年会上,进一步公布了该研究的最终分析结果数据,“双艾”联合组的mOS为23.8个月,而索拉非尼组仅为15.2个月;(HR=0.64,单侧P<0.0001);同时,2年OS率分别为49.0%和32.6%,3年OS率分别为37.7%和24.8%。
➤更多的晚期联合治疗方案在近期的研究结果中取得了良好的效果:
我国肝癌五年生存率仍处低位,如何通过有效干预提升肝癌的早期发现、早诊早治,提高治愈率,降低疾病负担,是当前面临的挑战,患者分层管理是突破难点的重要方向。《原发性肝癌 二级预防共识(2021年版)》对不同风险人群的监测随访策略进行了详细规范,为临床实践提供重要指导。
二级预防共识(2021年版)》对不同风险人群的监测随访策略进行了详细规范,为临床实践提供重要指导。
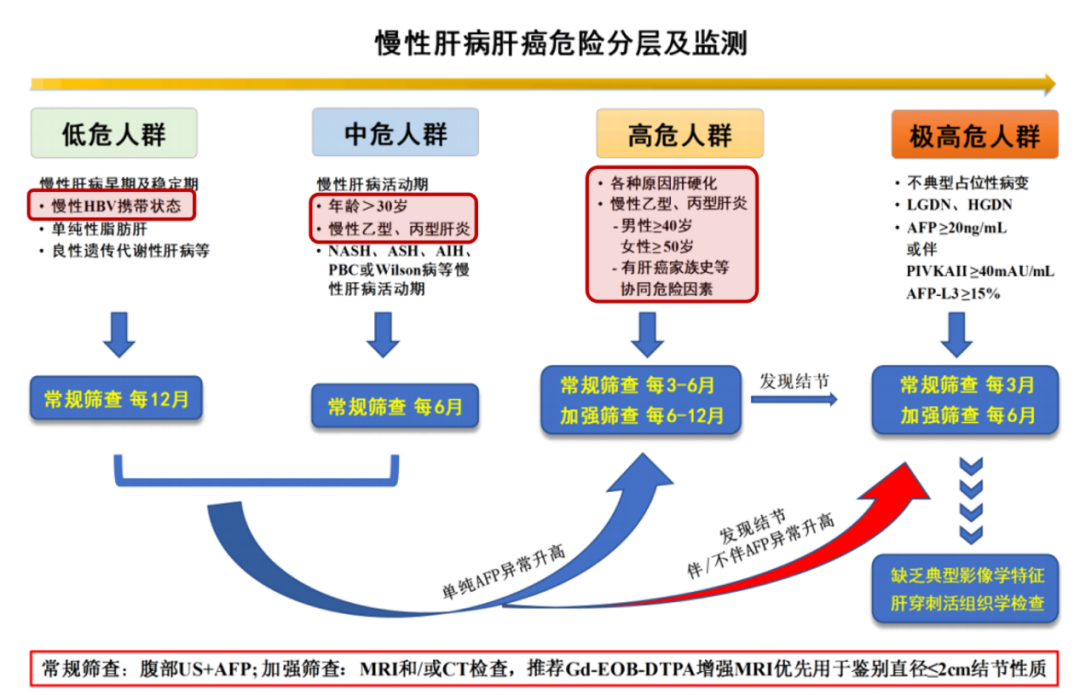
HCC危险人群分层级筛查流程图
日本肝癌生存率较高,其成功经验证实高危人群的筛查和随访对提高肝癌患者生存帮助巨大。其得益于建立完善的普遍筛查体系:医生对肝癌筛查认知度高;不同区域配备专人开展针对医生和公众的科普宣教,提升全社会对肝癌筛查的重视程度。
筛查肝癌慢性乙肝、丙型肝炎等高危人群非常重要。布局乙肝筛查优化策略,推广居家自检唾液表面抗原筛查、社区层面DNA检测等方式可扩大筛查覆盖面;例如,海南地区推行全面乙肝筛查,将患者进行早期干预和抗病毒治疗,降低终末期事件发生,通过定期肝癌筛查大幅提高早期诊断率,减轻疾病负担。
在肝癌的预防方面,强调全人群的预防。疫苗接种是一级预防的重要措施,我国乙肝疫苗接种成效显著,青少年乙肝感染率明显下降。二、三级预防在肝癌全病程管理中十分重要,慢乙肝防治指南扩大抗病毒治疗适应症,通过广泛治疗降低乙肝患者肝癌发生风险。而对于根治性治疗后的肝癌患者,抗病毒治疗也可减少肝癌的复发。为进一步降低肝癌风险,我国专家发起包括“绿洲项目”(全人群大样本二级预防队列)、“强盾项目”(高风险人群-肝癌家族史人群大样本二级预防队列)、“终结项目”(高风险人群-肝硬化人群大样本二级预防队列)等真实世界研究,目标直指最大程度减轻肝炎危害。
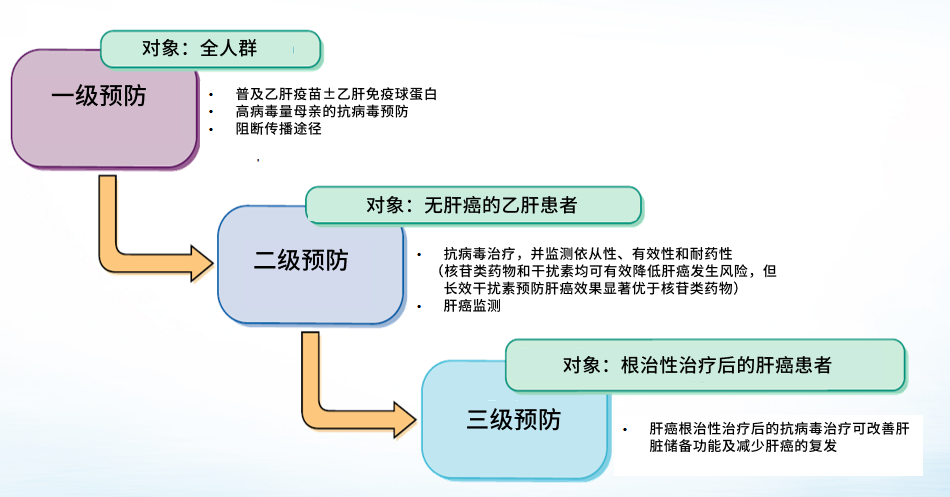
通过肝癌的二级预防可以大幅降低乙肝患者的肝癌发生风险
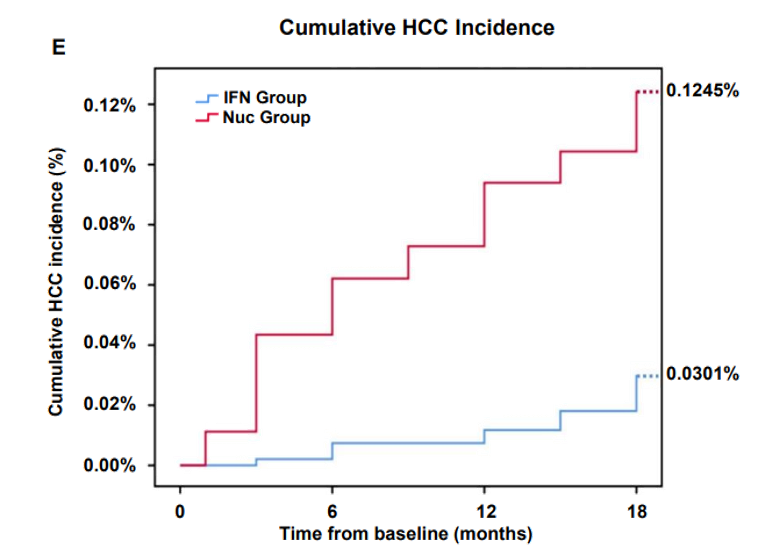
现阶段临床证据表明,抗病毒治疗是降低肝癌风险的基础,而联合干扰素治疗可能是有效的手段之一。例如,“绿洲” 项目研究共纳入32,071例患者,其中22,492例接受基于PEG IFNα的治疗,9,579例接受NAs治疗。在分析时间点,共有6,978名患者完成了48周的随访。研究分析显示:28例患者在18个月内发生肝癌。PEG IFNα组的累积肝癌发生率显著低于NAs组(0.0301% vs. 0.1245%,p < 0.0001)。通过COX回归调整包括年龄、肝硬化状态和基线HBsAg水平在内的协变量后,两组间的差异仍然显著(p < 0.0001),与NAs治疗相比,PEG IFNα治疗组发生肝癌的HR为0.153,表明相比于NAs,PEG IFNα可进一步降低85%的肝癌发生风险。
通过探索更多的肝癌术后辅助治疗手段,可以助力肝癌的三级预防。
IFN联合NAs可能是一种预防HCC治疗后复发的策略之一。另外,研究显示肝癌术后HBsAg清除对于降低肝癌复发有着重要的作用。纳入韩国2520例接受根治性肝切除术的HBV相关早期(BCLC 0期或A期)肝癌患者的研究显示,术后中位随访6.9年期间,6.8%的患者获得HBsAg清除,中位清除时间为3.6年。研究结果表明,HBsAg清除与肝癌复发风险显著降低相关,未获得HBsAg清除的患者更早出现肝癌远期复发。因此,肝癌患者仍需追求HBsAg清除。
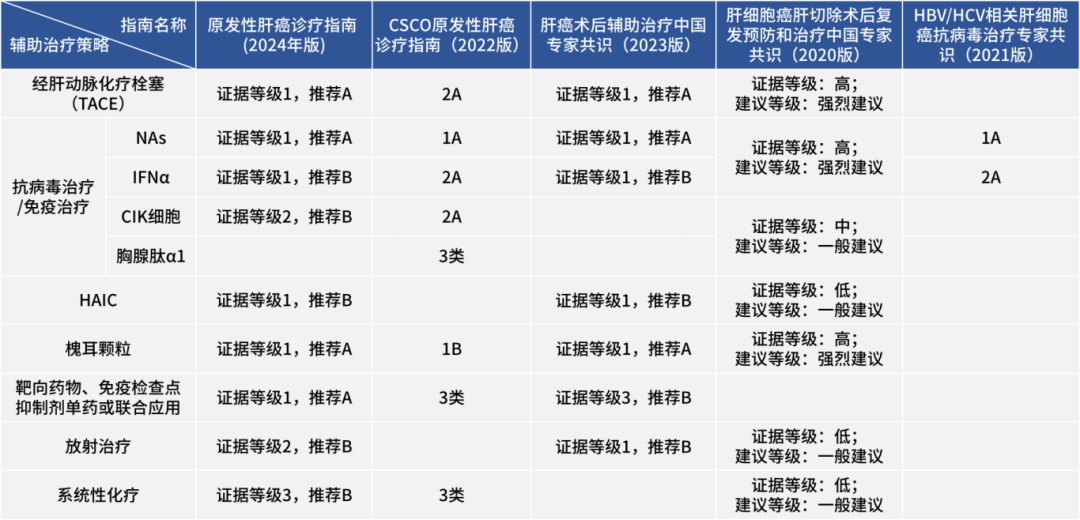
新辅助治疗与转化治疗是提高肝癌患者治疗效果重要手段。《原发性肝癌诊疗规范2024版》指出,针对适合手术切除但存在术后高危复发转移风险的肝癌患者(CNLC Ⅰb~Ⅱa 期和部分 CNLC Ⅱb、Ⅲa 期 ),在术前先进行局部治疗或系统抗肿瘤治疗,以期消灭微小病灶,降低术后复发转移概率,延长患者生存期。而对于不适合手术切除的肝癌患者,经过干预后获得手术切除的机会,干预手段包括有功能的FLR转化、肿瘤学转化等。系统抗肿瘤治疗和/或联合局部治疗已成为不可切除或中晚期肝癌的重要治疗方式,也是肝癌转化治疗的重要手段。
➤EMERALD-1研究是靶免(度伐利尤单抗 +贝伐珠单抗
+贝伐珠单抗 )联合TACE治疗适合栓塞的不可切除HCC、随机对照、全球多中心的III期研究,研究中期分析结果显示,与单独使用TACE相比,联合治疗可以显著改善中晚期HCC患者的无进展生存期(PFS)(mPFS分别为15.0个月和8.2个月),即获得了预期的PFS阳性结果。
)联合TACE治疗适合栓塞的不可切除HCC、随机对照、全球多中心的III期研究,研究中期分析结果显示,与单独使用TACE相比,联合治疗可以显著改善中晚期HCC患者的无进展生存期(PFS)(mPFS分别为15.0个月和8.2个月),即获得了预期的PFS阳性结果。
➤干扰素联合PD-1可能带来肝癌晚期治疗的新思路
复旦大学附属华山医院钦伦秀团队通过分析PEG IFNα对肝癌免疫微环境中肿瘤浸润免疫细胞和PD-1表达的影响,并探讨其潜在机制。在皮下荷瘤小鼠和原位肝癌小鼠模型中评估PD-1抗体和PEG IFNα在体内的作用。在原位肝癌小鼠模型中,与对照组或单药治疗组相比,联合治疗组明显延缓了肿瘤重量的增加,减少了肺转移的数量,并延长了总生存,表明PEG IFNα联合PD-1抗体治疗肝癌具有显著的协同作用。
其机制探索包括:
①PEG IFNα通过诱导肝癌细胞分泌CCL4来招募细胞毒性CD8+T细胞浸润肿瘤微环境。②PEG IFNα还可通过IFNα-IFNAR1-JAK1-STAT3途径上调CD8+T细胞PD-1的表达,长期使用容易引起其耗竭。
③PEG IFNα联合PD-1抗体则可恢复甚至增强CD8+T细胞的细胞毒效应,具有协同抗肿瘤作用。
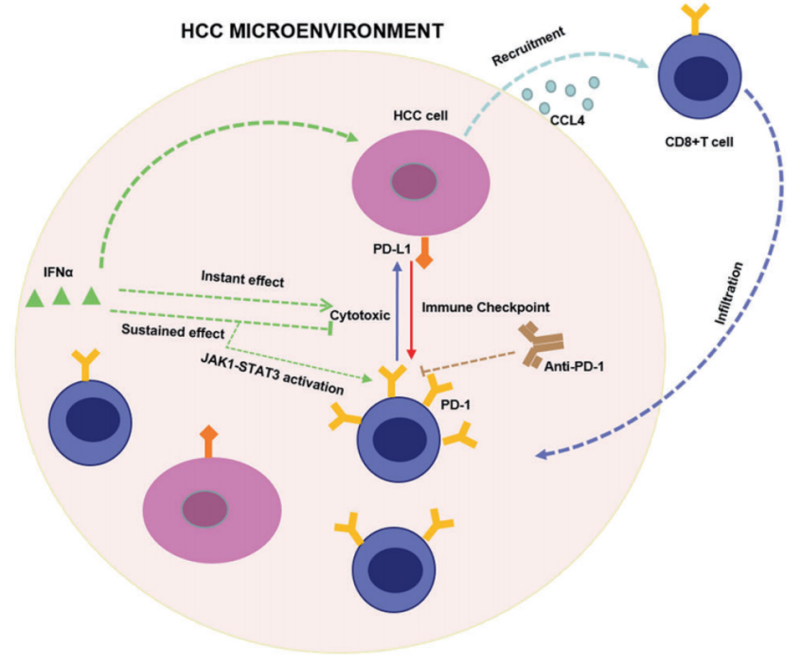
PEG IFNα联合PD-1抗体抗肿瘤作用的信号示意图
四、结语
总之,目前我国肝癌防治仍面临严峻挑战。针对乙肝等基础肝病的病因治疗是根本,需通过全面筛查发现并规范治疗慢性肝炎、脂肪肝 等高危人群,阻断肝硬化进展,并降低肝癌风险。同时构建高风险人群早期预警、分层随访筛查体系,对肝癌进行早筛早诊早治,并结合干扰素联合抗病毒治疗及靶向、免疫治疗等综合干预手段减少肝癌复发,以减轻疾病负担。
等高危人群,阻断肝硬化进展,并降低肝癌风险。同时构建高风险人群早期预警、分层随访筛查体系,对肝癌进行早筛早诊早治,并结合干扰素联合抗病毒治疗及靶向、免疫治疗等综合干预手段减少肝癌复发,以减轻疾病负担。

王贵强 教授
二级教授 主任医师 博士研究生导师
第六届中央保健专家组成员
中华医学会感染病学分会第十一届主任委员
中国医院协会抗微生物药物合理应用工作委员会主任委员
中华医学会学术工作专家委员会委员中国医师协会感染病医师分会副会长
中国研究型医院协会移动医疗专家委员会副主任委员
中国科协联合国咨商生命科学与人类健康专家委员会委员
国家免疫规划专家咨询委员会委员
国家卫健委医疗应急专家组感染病专业组组长
国家卫健委医疗机构感染防控专家委员会副主任委员
国家卫健委药事管理和药物治疗学委员会委员
国家卫健委传染病标准委员会委员
参考文献:
[1] Latest global cancer data. IARC, 2022.
[2] Huang DQ, Mathurin P, et al .Nat Rev Gastroenterol Hepatol. 2023 Jan;20(1):37-49. doi: 10.1038/s41575-022-00688-6. Epub 2022 Oct 18.
[3] asco.org/edbook | 2018 ASCO EDUCATIONAL BOOK;
[4] 秦叔逵 ,中国原发性肝癌临床登记调查(CLCS)的中期报告,2020CSCO
,中国原发性肝癌临床登记调查(CLCS)的中期报告,2020CSCO
[5] 中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南2022.
[6] Li Q, et al. Chin J Cancer Res 2022;34(6):554-566.
[7] Zhong JH, et al. Oncotarget, 2017, 8(11): 18296-18302.
[8] 肝癌术后辅助治疗中国专家共识 (2023版)
[9] 中华医学会肝病学分会. 原发性肝癌二级预防共识(2021年版). 中华肝脏病杂志,2021,29(3):216-226.
[10] Kudo M. Liver Cancer. 2012 Nov;1(3-4):141-3. doi:10.1159/000342749.
[11] Zhang QR, et al. EASL2023, Abstract (SAT-147).
[12] Yan SY, el at. . Current Cancer Drug Targets, 2017, 17, 505-511
[13] Su Jong Yu, et al. World J Gastroenterol. 2014 Sep 14; 20(34) 12039–12044;
[14] Shu Yang, et al. World J Surg Oncol. 2016;14159.
[15] Yoo S, et al. J Hepatol. 2022. PMID: 35643206
[16] Riccardo Lencioni , Masatoshi Kudo , Joseph Erinjeri ,et al. 2024 ASCO GI LBA432.
[17] Zhu Y, et al. Cell Mol Immunol, 2022 Jun;19(6):726-737.
注:图片引自讲者会议幻灯

