
菲常血液丨李菲教授:从免疫病理学机制到临床转化全面解析HLH靶向治疗新进展
医脉通编辑整理,未经授权请勿转载。
概述
噬血细胞性淋巴组织细胞增多症(HLH)是由细胞毒性淋巴细胞(CTLs)和巨噬细胞过度活化引发的高炎症性疾病,以免疫调节异常触发细胞因子风暴、导致组织损伤及多器官功能障碍为特征。HLH病理机制复杂,涉及多重免疫失调、病因多样及临床异质性,药物研发难度大,目前临床尚缺乏有效靶向治疗,本文从转化医学视角解析免疫病理机制,并汇总了HLH可能的新兴治疗靶点及其临床应用,为临床研究和诊疗提供潜在思路。
免疫病理学视角下HLH的发病机制
1.NK细胞与CTL功能缺陷
自然杀伤细胞(NK细胞)与细胞毒性T淋巴细胞(CTL)通过Fas配体(CD95-L)介导的凋亡途径和穿孔素依赖性颗粒分泌途径清除异常细胞。正常情况下,激活的NK/CTL通过微管运输细胞毒性颗粒至免疫突触,经迁移、锚定、融合后释放穿孔素与颗粒酶,诱导靶细胞凋亡并抑制免疫激活[1,2]。
原发性HLH(P-HLH)的核心是基因突变导致细胞毒性功能障碍 :PRF1(穿孔素合成缺陷)、UNC13D(颗粒胞吐异常)、STX11/STXBP2(囊泡运输障碍)及LYST(Chédiak-Higashi综合征)、SH2D1A(XLP-1)突变破坏淋巴细胞毒性调控[3,4]。这些缺陷导致颗粒酶/穿孔素介导的杀伤失效,感染/肿瘤细胞持续存活并激活免疫系统,引发IFN-γ过量分泌及巨噬细胞驱动的细胞因子风暴。值得注意的是,CD56bright NK细胞亚群IFN-γ分泌减少,继发性HLH(S-HLH)中CD56dim NK细胞杀伤力下降,进一步加剧病理进程[5]。(图1A)
:PRF1(穿孔素合成缺陷)、UNC13D(颗粒胞吐异常)、STX11/STXBP2(囊泡运输障碍)及LYST(Chédiak-Higashi综合征)、SH2D1A(XLP-1)突变破坏淋巴细胞毒性调控[3,4]。这些缺陷导致颗粒酶/穿孔素介导的杀伤失效,感染/肿瘤细胞持续存活并激活免疫系统,引发IFN-γ过量分泌及巨噬细胞驱动的细胞因子风暴。值得注意的是,CD56bright NK细胞亚群IFN-γ分泌减少,继发性HLH(S-HLH)中CD56dim NK细胞杀伤力下降,进一步加剧病理进程[5]。(图1A)
2.CTLs异常活化
HLH的典型特征是CD8⁺细胞毒性T淋巴细胞(CTL)过度激活。研究显示,HLH患者激活的T细胞以CD38high/HLA-DR⁺效应表型为主,其中CD8⁺ T细胞激活最显著[6]。CTL细胞毒性功能障碍使其无法清除病原体,导致抗原呈递细胞(APC)或刺激因素(感染、CAR疗法、肿瘤等)持续激活T细胞,引发CTL异常扩增及过量细胞因子分泌;过量炎症因子驱动巨噬细胞过度活化,放大炎症级联反应,形成自我维持的炎症循环,加剧组织损伤并促进HLH进展[7]。(图1B)
3.巨噬细胞异常活化
巨噬细胞起源于循环单核细胞,通过Toll样受体(TLR)和Fcγ受体(FcγR)识别病原相关分子模式(PAMPs)或免疫复合物。TLR激活后通过MyD88依赖性通路(NF-κB活化)或TRIF依赖性通路(IFN-β诱导)触发促炎因子分泌,FcγR结合免疫复合物后通过Syk激酶-PLCγ-Ca²+信号轴放大炎症反应。在巨噬细胞活化综合征(MAS)中,自身抗体介导的FcγR交联与TLR4协同作用,诱导M1型极化并释放IL-1β、IL-6等促炎介质[8,9]。此外,CAR疗法通过穿孔素/颗粒酶介导的细胞焦亡释放DAMPs,激活TLR9并驱动IFN-γ、TNF-α等细胞因子风暴,导致遗传易感个体出现持续性器官功能障碍。这些机制共同构成HLH病理进程中免疫失调的核心环节。(图1C)
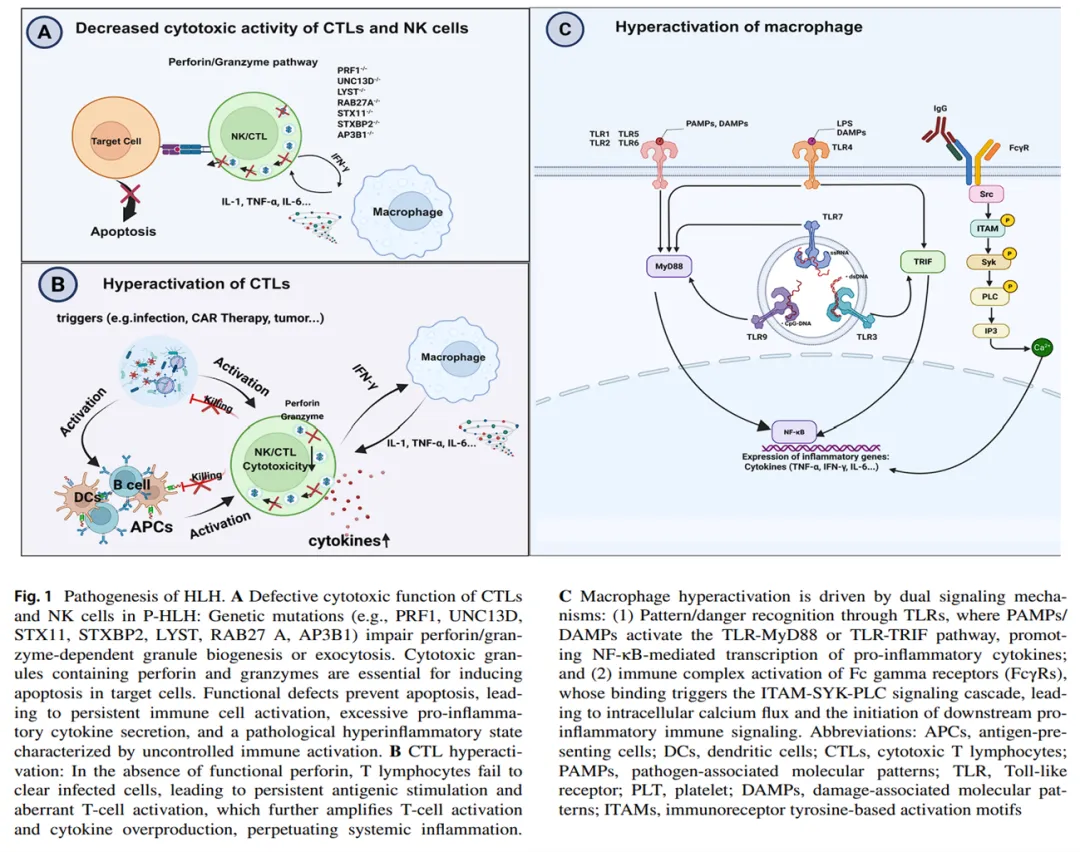
图1
HLH的潜在新型靶向治疗
尽管HLH-94方案仍是成人HLH的标准治疗,但其疗效显著低于儿童(约20%-30%成人无应答),且缺乏明确二线治疗。本文总结HLH治疗的潜在靶点(图2)。
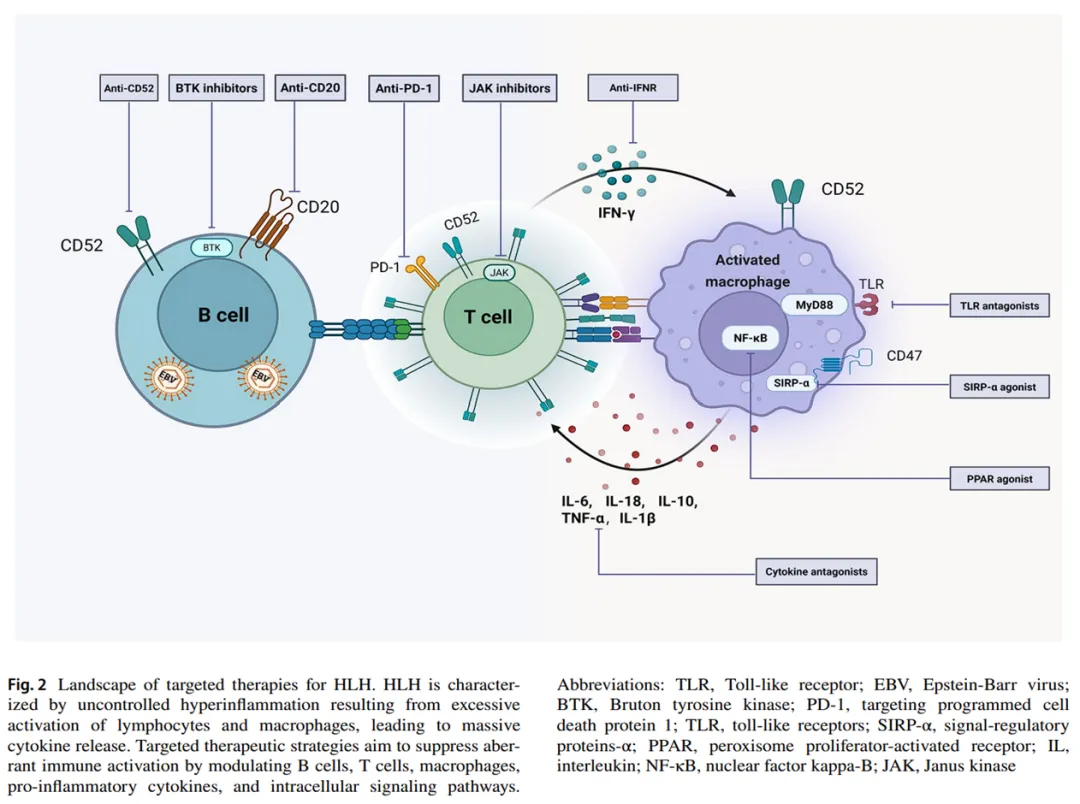
图2
1.靶向免疫细胞
针对EBV-HLH,CD20单抗(如利妥昔单抗 )通过清除B细胞显著改善预后(B细胞感染患者总缓解率93.3%,降低EBV载量),但T/NK细胞感染亚型疗效有限,目前推荐作为EBV-HLH二线治疗,并在LA-HLH和MAS中展现价值。Alemtuzumab(阿伦单抗)通过耗竭T/B淋巴细胞,在P-HLH移植前桥接治疗中将HSCT生存率提升至91.6%(FDA批准),但S-HLH证据不足且可能诱发HLH,提示需严格遵循亚型特异性选择策略。
)通过清除B细胞显著改善预后(B细胞感染患者总缓解率93.3%,降低EBV载量),但T/NK细胞感染亚型疗效有限,目前推荐作为EBV-HLH二线治疗,并在LA-HLH和MAS中展现价值。Alemtuzumab(阿伦单抗)通过耗竭T/B淋巴细胞,在P-HLH移植前桥接治疗中将HSCT生存率提升至91.6%(FDA批准),但S-HLH证据不足且可能诱发HLH,提示需严格遵循亚型特异性选择策略。
2.靶向细胞因子
HLH的核心是IFN-γ、IL-6、IL-1β、TNF-α、IL-18等细胞因子通过JAK/STAT、NF-κB通路形成正反馈循环。靶向治疗突破显著:① IFN-γ单抗Emapalumab(2018年FDA批准)中和IFN-γ,联合地塞米松 治疗P-HLH的1.5年生存率达54.3%,S-HLH的12个月生存率85.7%;② IL-6抑制剂Tocilizumab在感染相关HLH中缓解率88.9%,但存在诱发HLH争议;③ IL-1受体拮抗剂Anakinra在MAS中完全缓解率100%,但对P-HLH效果有限;④ IL-18/IL-18BP轴调控新靶点,Tadekinig alfa抑制IL-18显著改善NLRC4-MAS预后;⑤ IL-33/ST2通路在动物模型显示抗炎潜力,临床转化待验证。靶向治疗需严格亚型特异性(如CD20单抗仅适用于EBV-HLH),联合用药(如JAK抑制剂+Emapalumab)可能协同增效,未来需大规模试验优化分层策略。
治疗P-HLH的1.5年生存率达54.3%,S-HLH的12个月生存率85.7%;② IL-6抑制剂Tocilizumab在感染相关HLH中缓解率88.9%,但存在诱发HLH争议;③ IL-1受体拮抗剂Anakinra在MAS中完全缓解率100%,但对P-HLH效果有限;④ IL-18/IL-18BP轴调控新靶点,Tadekinig alfa抑制IL-18显著改善NLRC4-MAS预后;⑤ IL-33/ST2通路在动物模型显示抗炎潜力,临床转化待验证。靶向治疗需严格亚型特异性(如CD20单抗仅适用于EBV-HLH),联合用药(如JAK抑制剂+Emapalumab)可能协同增效,未来需大规模试验优化分层策略。
3.靶向HLH促炎信号通路
信号通路层面进展显著:①JAK/STAT通路核心调控,抑制剂Ruxolitinib阻断IL-6、GM-CSF等信号,在S-HLH中28天早期缓解率83.3%,联合低剂量抗IFN-γ抗体协同增强疗效;②BTK通路靶向治疗在CAR-T相关HLH中初显潜力,新型PROTAC化合物降解BTK蛋白抑制NF-κB活化;③TLR信号抑制剂CRT0066101双重阻断MyD88/TLR4通路,降低NLRP3炎症小体活性,动物实验 减轻组织损伤;④NF-κB调控方面,PPAR-γ激动剂(如罗格列酮
减轻组织损伤;④NF-κB调控方面,PPAR-γ激动剂(如罗格列酮 )促进M2型巨噬细胞极化,降低病毒相关性HLH模型TNF-α水平。值得注意的是,JAK抑制剂已进入III期临床(NCT05137496),而TLR/NF-κB通路药物尚处临床前,未来需加强多靶点协同(如JAKi+BTKi)及交叉调控机制研究,突破单一靶点疗效瓶颈。
)促进M2型巨噬细胞极化,降低病毒相关性HLH模型TNF-α水平。值得注意的是,JAK抑制剂已进入III期临床(NCT05137496),而TLR/NF-κB通路药物尚处临床前,未来需加强多靶点协同(如JAKi+BTKi)及交叉调控机制研究,突破单一靶点疗效瓶颈。
4.靶向免疫检查点
免疫检查点靶向治疗为HLH提供新策略:① PD-1/PD-L1通路在EBV-HLH中双向调控(EBV-LMP1/NF-κB诱导PD-L1过表达促进免疫逃逸;PD-1抑制剂如纳武利尤单抗 单药治疗5/7例复发EBV-HLH患者获持续完全缓解,联合化疗降低NK/T细胞淋巴瘤
单药治疗5/7例复发EBV-HLH患者获持续完全缓解,联合化疗降低NK/T细胞淋巴瘤 相关HLH的EBV-DNA载量);② CD47/SIRP-α轴作为新型免疫逃逸机制,靶向SIRP-α的单抗ELA026增强巨噬细胞吞噬功能,在S-HLH中展现快速减瘤效应,全球多中心Ib期试验(NCT05416307)初步证实安全性及早期疗效。值得注意的是,PD-1信号可能抑制效应T细胞功能加重HLH,ICI相关HLH发生率低(0.4%)但已有诱发病例,需精准筛选治疗窗。当前PD-1/PD-L1抑制剂限于个案/小样本,CD47/SIRP-α靶向治疗需解决脱靶效应及血液学毒性,未来联合JAK抑制剂或IFN-γ阻断剂可能是突破方向。
相关HLH的EBV-DNA载量);② CD47/SIRP-α轴作为新型免疫逃逸机制,靶向SIRP-α的单抗ELA026增强巨噬细胞吞噬功能,在S-HLH中展现快速减瘤效应,全球多中心Ib期试验(NCT05416307)初步证实安全性及早期疗效。值得注意的是,PD-1信号可能抑制效应T细胞功能加重HLH,ICI相关HLH发生率低(0.4%)但已有诱发病例,需精准筛选治疗窗。当前PD-1/PD-L1抑制剂限于个案/小样本,CD47/SIRP-α靶向治疗需解决脱靶效应及血液学毒性,未来联合JAK抑制剂或IFN-γ阻断剂可能是突破方向。
总结
HLH病理生理学进展加速了生物标志物指导的治疗进入临床实践。针对复发/难治性HLH(R/R HLH),整合靶向治疗与传统疗法可实现精准策略;IL-1β/TNF-α双重阻断对MAS亚型疗效显著。精准序贯靶向在平衡疗效与免疫毒性方面展现潜力,但需多中心验证。当前局限包括协同机制未明及多为孤立疗效报告而非系统研究。这些细胞因子/通路靶向策略通过改善生存、减少毒性及个性化,有望重塑HLH管理模式。

李菲 教授
南昌大学第一附属医院血液病 中心主任医师、教授、博士生/博士后合作导师
中心主任医师、教授、博士生/博士后合作导师
江西省血液系统疾病重点实验室主任
江西省血液病临床医学研究中心主任
江西省血液病医疗质控中心主任
南昌大学淋巴肿瘤疾病研究所主任
中华血液学杂志通讯编委,临床血液学杂志、中国临床肿瘤杂志编委
中华医学会血液学分会常务委员
中华医学会血液学分会淋巴疾病学组委员
国家血液病质控中心专家委员会委员
江西省医学会血液学分会候任主委
中国CSCO骨髓瘤 专家委员会副主任委员
专家委员会副主任委员
中国CSCO抗淋巴瘤联盟委员
中国医药教育协会造血干细胞移植 和免疫治疗分会副主任委员
和免疫治疗分会副主任委员
中国抗癌协会血液肿瘤(肿瘤血液)专委会委员
中国慢淋专家组委员
中国噬血细胞综合征 联盟专家组委员
联盟专家组委员
中国女医师协会靶向专委会血小板病副组长

杨园园 博士
南昌大学医学部第一临床医学院2024级博士研究生(导师:李菲教授)
以第一作者/共同第一作者身份于Experimental Hematology & Oncology,Clinical Reviews in Allergy & Immunology等期刊发表SCI论文5篇,北大核心论文2篇。

