
创新药物的中国叙事:全新一代BCL-2抑制剂利沙托克拉从实验室走向临床
中国创新药的崛起之路,是一部从跟随到并跑、再到超越的奋斗史。十年前,中国早期新药研发路径以跟跑的“Me-too”策略为主——即通过对原研药分子结构进行修饰优化,开发出疗效相似的药物,这也使得药物同质化现象突出。随后,中国创新药从“Me-too”药物开始向“Me-better”、“Best-in-class”转型。
在这一转型浪潮中,BCL-2靶点因涉及慢性淋巴细胞白血病(CLL)等多种血液肿瘤,因此成为领域研发的热门靶点之一,但由于成药困难,BCL-2抑制剂也因此成为检验中国原研实力的领域之一。近期获批的利沙托克拉为我国原创的全新一代BCL-2抑制剂,有望成为本土药企实现“Best-in-class”的标志性成果之一。
BCL-2靶点“不可成药”之困如何突破?
抗凋亡蛋白BCL-2是抗肿瘤领域的经典靶点,自1984年靶点发现,近40年来针对该靶点的研究数不胜数,但成药屈指可数1。尽管业内普遍认为,BCL-2抑制剂小分子药物可以特异性杀死恶性肿瘤,同时保留正常细胞,还必须能够阻断蛋白质-蛋白质相互作用,但在当时看来这是一项非常具有挑战性的任务。
吴德沛教授:
BCL-2成药困难,数十年来多个药物在研发路途中“折戟”:ABT-737是成功靶向蛋白质-蛋白质相互作用的首批例子之一,并表明该靶点确实是可成药的。然而,ABT-737不具有口服生物利用度,其类似物ABT-263(navitoclax)虽然提高了口服生物可利用度,但却在临床试验中观察到明显的剂量限制性毒性(DLT),原因在于抑制BCL-xL……直至2016年,FDA才批准了第一款BCL-2抑制剂(ABT-199),开启了其在恶性肿瘤的治疗旅程2。
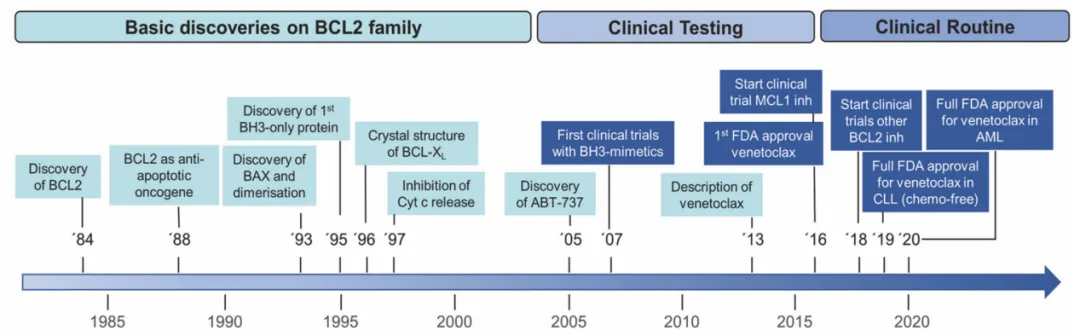
BCL-2靶点研发历程
从AT-101到利沙托克拉:30年磨一剑的研发突破
在颇为坎坷的BCL-2成药之路上,亚盛医药以创新为锚,在凋亡通路研究领域沉淀许久,对BCL-2靶点的开发历程已有30年,是全球是较早投身该领域研究的团队之一。早在2004年率先将首个BCL-2选择性抑制剂AT-101推向全球临床, 2011年开发出血小板毒性低的新一代BCL-2/BCL-xL双靶点药物(APG-1252)启动药效学研究,相关研发工作持续至今。后续推出的利沙托克拉(APG-2575),成为中国首个提交关键注册研究并获批上市的原创BCL-2抑制剂。该药物的研发并非源于对一代药物的分子优化,而是基于团队数十年在细胞凋亡领域的经验与技术积累,基于AT-101和APG-1252工作基础上的新药研发,自研发起始便具有自主创新性。该全新一代BCL-2抑制剂具有Best-in-class潜力,展现了本土企业强劲的创新实力。
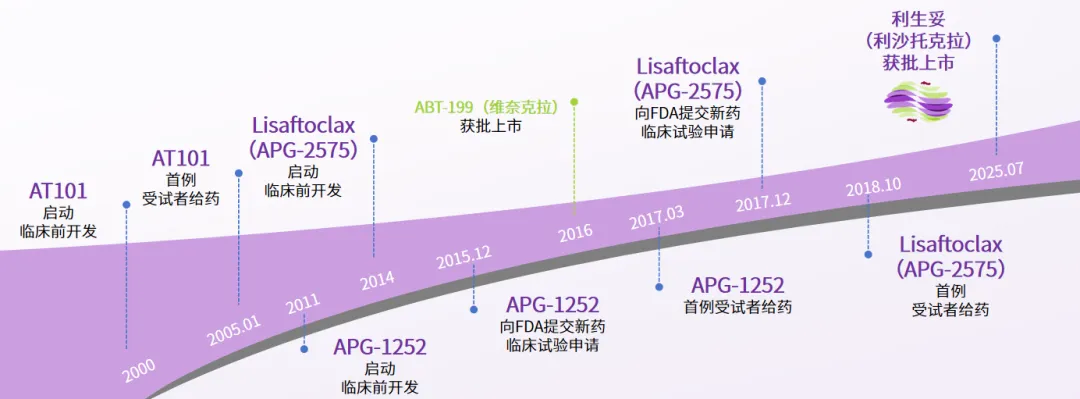
利沙托克拉研发历程图
杨大俊博士:
40年前,抗凋亡蛋白BCL-2的发现标志着我们对程序性细胞死亡调节的理解取得了突破,不过该领域药物研发存在不少挑战:首先,BCL-2靶点的结合界面相对较大3,大约有13~15个氨基酸,很难设计小分子实现特异性抑制并发挥阻断作用;其次,BCL-2蛋白家族包括BCL-2、BCL-xL、BCL-w等多个成员,早期多靶点抑制剂同时抑制多个成员,会引发严重不良反应——BCL-xL对维持血小板存活至关重要,其抑制会导致血小板减少甚至出血风险,引发不容忽视的安全性问题,如何实现高选择性地抑制BCL-2是核心挑战;此外,BCL-2靶点位于线粒体膜上,线粒体是双层膜结构,药物需先通过细胞膜进入胞质,再穿透线粒体外膜和内膜,这一过程要求药物兼具脂溶性和极性,使得药物设计难度加大。我国原创的全新一代BCL-2抑制剂利沙托克拉成功获批,这一进展无疑是我们十五年深耕历程中又一个具有标志性意义的里程碑。
药理突破:如何打造“完美”的BCL-2抑制剂?
利沙托克拉的获批之路,离不开相关研发人员在细胞凋亡领域的20余年深耕,为攻克BCL-2靶点“不可成药”这一难关所付出的努力。2013年,APG-2575被确定为合适的新分子,2018年开始进入临床试验测试。
不同于维奈克拉,利沙托克拉具有更短的半衰期(约5小时),实现疗效和安全性的良好平衡4,5。其相关凋亡通路的开启类似多诺米古牌,只要药物浓度达到相应水平即可启动凋亡,即为Cmax Driven(峰浓度驱动),而非AUC(曲线下面积)驱动。当利沙托克拉竞争性结合抗凋亡蛋白后,促凋亡蛋白BIM被释放,诱导促凋亡孔形成蛋白BAX和BAK结构进行结构重组。一旦凋亡通路开启,促凋亡蛋白BIM即刻分离,这一凋亡通路的机制文献称为“Hit and Run”理论。这种特性使得利沙托克拉在每日给药时,既能保障疗效,又可减少毒性累积,实现疗效与安全性的平衡。
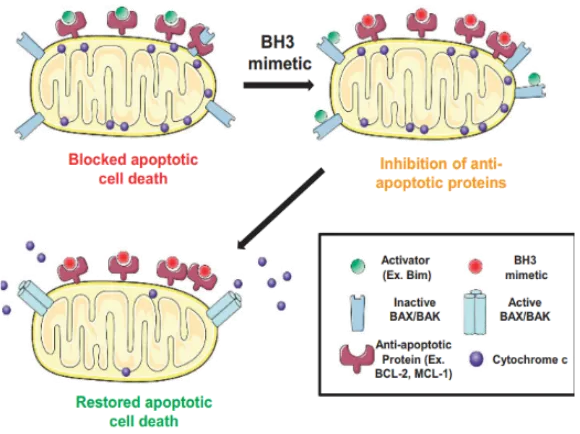
利沙托克拉诱导肿瘤细胞凋亡作用机制
翟一帆博士:
利沙托克拉在临床前研究及首次临床试验的设计阶段便形成了差异化布局。自2018年1月至今,其全球临床试验已覆盖18个国家、360家医院,累计入组超1300例患者,涵盖Ⅰ至Ⅲ期共25项试验。正是依托大规模临床试验积累的丰富数据,该药物得以成为中国自主研发并在国内获批上市的BCL-2抑制剂。目前利沙托克拉相关的四项全球注册Ⅲ期临床研究正在进行中,除CLL/SLL领域外,在急性髓系白血病、骨髓增生异常综合征、多发性骨髓瘤等领域的研究也进展迅速。
临床验证:疗效、安全与可及性的三重平衡
当前研究证实,利沙托克拉无论是单药还是联合治疗,均实现了高效缓解。
在CC201这项关键注册研究中,纳入了诸如对BTK抑制剂和免疫化疗难治、复发或不耐受,或者伴有高危因素等不良预后因素且不适合免疫化疗的患者,这些既往多重治疗或者伴有高危因素的患者经过利沙托克拉治疗后,无论是独立评估委员会亦或研究者评估的结果,均取得了良好治疗反应和生存获益,更重要的是无TLS事件导致的剂量减少、终止治疗或者死亡发生。在较早时间进行的Ⅰ和Ⅱ期研究中也呈现出了同样的治疗反应和安全性。
利沙托克拉联合BTK抑制剂或CD20单抗具有协同潜力,且安全性良好。在CU101研究中,利沙托克拉联合阿可替尼治疗CLL/SLL,总缓解率(ORR)达98%,即使为对维奈克拉难治的患者,ORR仍高达89%7。总体患者的12个月和18个月的无进展生存(PFS)率分别为84%和73%。在安全性方面,利沙托克拉联合阿可替尼或利妥昔单抗时,均未观察到药物相互作用(DDI)或新的安全性信号。
金洁教授:
利沙托克拉具有更高的靶点亲和力和抗肿瘤活性,无论是单药还是联合治疗均为患者带来高缓解率;此外,基于药代动力学方面半衰期较短(约5小时)的独特优势,利沙托克拉具有更好的安全性,临床关注的TLS发生率较低,血液学毒性发生率较低且恢复较快,安全性原因导致的剂量调整和治疗终止非常少见;其与BTK抑制剂联合应用时无需导入期,可使患者更快进入联合治疗阶段,从而提高了治疗便利性和依从性,同时也具备了更加快速控制病情的优势4,5。
价值跃迁:从本土到全球,定义“全新一代”
利沙托克拉已获得5项美国FDA授予的孤儿药资格认证(ODD),用于治疗CLL、华氏巨球蛋白血症(WM)、多发性骨髓瘤(MM)、急性髓系白血病(AML)、以及滤泡性淋巴瘤(FL),以及快速通道资格(Fast Track)等多项国际认可。这标志着创新药在全球市场的“同步起跑”,具有重要的象征意义。
从“Me-too”到“Best-in-class”,这不仅是一种简单的跃迁,而是对机制、需求、路径和价值的系统性重构。利沙托克拉的研发与成功获批不仅展现了中国药企的决心,也体现了中国原研药物走向全球标准的技术实力。
杨大俊博士:
当前我们已建立了丰富的创新药产品管线,涵盖了抑制BCL-2、MDM2-p53等细胞凋亡通路关键蛋白的抑制剂,以及针对癌症治疗中出现的激酶突变体的新一代抑制剂,并与梅奥医学中心、丹娜法伯癌症研究院等国际顶级机构建立全球合作关系。这充分印证了我们“解决中国乃至全球患者未满足临床需求,研发具有全球First-in-class或Best-in-class潜力的原创新药”的使命承诺,未来,我们将持续朝着“推动中国创新药从跟跑迈向并跑、领跑”的目标坚定前行。
小结
随着利沙托克拉近期获批成为中国首个原创的全新一代BCL-2抑制剂,中国创新药正在完成从跟跑到并跑再到领跑的关键跃迁。这一历程不仅为全球患者提供高效、安全、便捷的治疗选择,更向世界证明——在攻克“不可成药”靶点的征程上,中国研究人员已成为中坚力量。

吴德沛 教授
主任医师、教授、博士生导师
苏州大学附属第一医院血液科主任
国家血液系统疾病临床医学研究中心常务副主任
江苏省血液研究所副所长
苏州大学造血干细胞移植研究所所长
首届百名国家杰出医师
全国先进工作者
第十三届、十四届全国政协委员
中华医学会血液学分会第十一届主任委员
中国医药教育协会真菌病专业委员会主任委员
中国造血干细胞捐献者资料库专家委员会副主任委员
《中华血液学杂志》第十届总编辑

金洁 教授
医学博士,二级教授,博士生导师
享受国务院特殊政府津贴,全国卫生系统先进工作者
浙江大学医学院附属第一医院终身教授
浙江大学血液肿瘤(诊治)重点实验室主任
国家卫健委临床重点学科-浙一医院血液学科带头人
浙江省血液病临床医学研究中心主任
浙江大学癌症研究院恶性血液病基础与临床研究负责人
中国女医师协会血液学专委会主任委员
抗癌协会血液疾病转化医学前任主任委员
中国医师协会血液学会常务委员
中国医师协会整合血液学会副主任委员
海峡两岸血液学会常务委员
中国健促会血液学会常务委员
浙江医学会血液学分会前任主任委员
浙江省医师学会血液学分会会长


