
李正发教授:ATRA联合方案治疗高危MDS的临床实践与人文思考
骨髓增生异常综合征(MDS)是一组起源于造血干细胞的异质性髓系克隆性疾病,其特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少,高危MDS(HR-MDS)患者的预后较差,且易进展为急性髓系白血病 (AML)1。去甲基化药物(HMA)作为不适合移植的HR-MDS患者的重要治疗手段,其疗效有限且可能出现血液学毒性,导致血细胞减少,严重影响患者预后。全反式维甲酸(ATRA)作为维生素A
(AML)1。去甲基化药物(HMA)作为不适合移植的HR-MDS患者的重要治疗手段,其疗效有限且可能出现血液学毒性,导致血细胞减少,严重影响患者预后。全反式维甲酸(ATRA)作为维生素A 的活性代谢产物,与HMA联合使用可进一步改善预后,为HR-MDS患者带来新的治疗选择。本文将介绍一例接受ATRA联合阿扎胞苷
的活性代谢产物,与HMA联合使用可进一步改善预后,为HR-MDS患者带来新的治疗选择。本文将介绍一例接受ATRA联合阿扎胞苷 治疗的HR-MDS患者的诊疗过程,并特邀云南省第一人民医院李正发教授对该病例进行点评。
治疗的HR-MDS患者的诊疗过程,并特邀云南省第一人民医院李正发教授对该病例进行点评。
病例简介
基本信息:女性,56岁。
主诉:2017-04-20,患者因“反复头晕、乏力”入院治疗。
基线检查
骨髓穿刺:MDS伴原始细胞增多(MDS-RAEB-2)骨髓象,原始细胞比例为15.5%。
骨髓活检:骨髓有核细胞增生活跃,原始细胞增生,粒系各阶段细胞可见,红系增生,早期细胞易见,巨核细胞增生,多为小巨核、单圆核、多圆核巨核细胞。
基因突变检测:TET2突变。
染色体 核型检测:染色体核型正常。
核型检测:染色体核型正常。
临床诊断
MDS(FAB分型:RARS,WHO分型:MDS-RAEB-2),IPSS-R:4.5分(高危组)。
治疗经过
2017-12-18,患者血常规 检查示:白细胞(WBC)1.52x109/L,血红蛋白
检查示:白细胞(WBC)1.52x109/L,血红蛋白 (Hb)75g/L,血小板计数(PLT)149x109/L,给予地西他滨
(Hb)75g/L,血小板计数(PLT)149x109/L,给予地西他滨 (30mg d1-5,20mg/m2)治疗,直至2021-06-24。
(30mg d1-5,20mg/m2)治疗,直至2021-06-24。
2022-01-09,患者复查示原始细胞比例为3.7%,WBC 1.63x109/L,Hb 122g/L,PLT 235x109/L,换用阿扎胞苷(100mg d1-8)+CAG(阿糖胞苷 ,蒽环类药物,粒细胞集落刺激因子
,蒽环类药物,粒细胞集落刺激因子 )方案治疗。患者出现高热,并在化疗过程中发生骨髓抑制伴肺部真菌感染
)方案治疗。患者出现高热,并在化疗过程中发生骨髓抑制伴肺部真菌感染 ,细菌性肺炎
,细菌性肺炎 ,导致三系减少,给予升细胞、抗感染等对症治疗后,患者病情好转,最终出院。
,导致三系减少,给予升细胞、抗感染等对症治疗后,患者病情好转,最终出院。
2022-12-23,患者再次入院复查,原始细胞比例为5.5%,给予ATRA(20mg bid,持续口服)+阿扎胞苷(100mg d1-7)治疗,直至2025-04-22。
2025-03-11,患者的原始细胞比例降至3%。
2025-04-22,患者复查血常规示WBC 2.48x109/L,Hb 110g/L,PLT 341x109/L。

图1 患者WBC水平变化
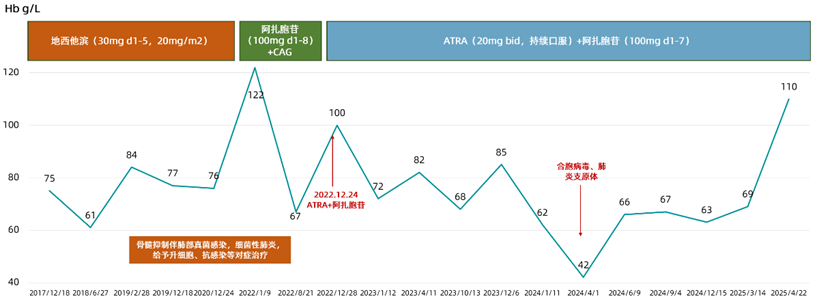
图2 患者Hb水平变化
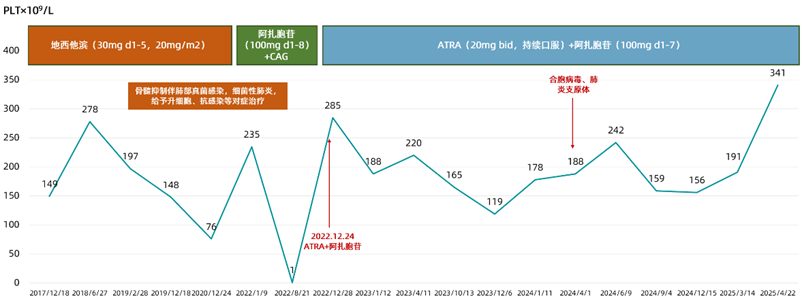
图3 患者PLT水平变化
病例总结
该患者诊断为高危MDS,病程已持续7年余。入院后,先后给予地西他滨及阿扎胞苷+CAG治疗,然而,患者出现高热,并在化疗过程中出现肺部真菌感染,细菌性肺炎,导致WBC和PLT水平大幅降低。
2022-12-23,给予患者ATRA联合阿扎胞苷治疗,目前已持续用药2年5个月,治疗后疾病无明显进展(原始细胞比例<5%),血象明显改善,且该方案安全性较好,患者耐受性良好,治疗后患者的输血 次数减少、输血间隔时间延长,血常规显示明显疗效。
次数减少、输血间隔时间延长,血常规显示明显疗效。
病例点评
MDS是一种高度异质性的疾病,其特点是造血细胞发育不全、分化紊乱及病变细胞凋亡增加,导致一系或多系血细胞减少2。HR-MDS患者的预后不良,且易进展为AML,改变疾病自然进程、提高总生存期(OS)并降低白血病转化风险,是HR-MDS患者治疗的主要目标3。异基因造血干细胞移植 (allo-HSCT)作为HR-MDS的唯一潜在治愈手段,仅适用于少数患者,对于大多数高龄、体能不良或伴有严重合并症的患者,HMA成为重要的治疗选择。然而,接受HMA单药治疗的HR-MDS患者临床结局并不令人满意,完全缓解(CR)率+部分缓解(PR)率为19-29%4,并且可能引起血液学毒性,并伴随长期血细胞减少,对于易发生感染和出血的患者,此类血液学毒性可能难以控制3,且HMA治疗失败的HR-MDS患者预期中位生存期<6个月5。因此,临床亟需探索更安全有效的治疗策略。
(allo-HSCT)作为HR-MDS的唯一潜在治愈手段,仅适用于少数患者,对于大多数高龄、体能不良或伴有严重合并症的患者,HMA成为重要的治疗选择。然而,接受HMA单药治疗的HR-MDS患者临床结局并不令人满意,完全缓解(CR)率+部分缓解(PR)率为19-29%4,并且可能引起血液学毒性,并伴随长期血细胞减少,对于易发生感染和出血的患者,此类血液学毒性可能难以控制3,且HMA治疗失败的HR-MDS患者预期中位生存期<6个月5。因此,临床亟需探索更安全有效的治疗策略。
ATRA作为维生素A的活性代谢产物,可通过诱导自噬信号传导、血管生成、细胞分化、细胞凋亡和免疫功能发挥作用,目前已在急性早幼粒细胞白血病 (APL)中广泛应用,并在MDS、原发免疫性血小板减少症
(APL)中广泛应用,并在MDS、原发免疫性血小板减少症 (ITP)等其他血液系统疾病中也发挥重要作用2。
(ITP)等其他血液系统疾病中也发挥重要作用2。
近年来,ATRA与HMA联合治疗MDS的临床研究已取得重要突破。体外研究证实4,ATRA与地西他滨联合治疗降低了MDS细胞活性、延缓了肿瘤细胞进展并延长小鼠生存。临床研究显示6,使用ATRA+低剂量地西他滨联合治疗31例不适合强化疗的髓系肿瘤患者(18例MDS,13例AML),患者总缓解率(ORR)为58.1%,中位总生存期为11.0个月,1年及2年OS率分别为41.9%和26.6%,主要不良反应是可耐受的血液学毒性。值得关注的是,浙江大学医学院附属第一医院佟红艳教授团队在2024年美国血液学会(ASH)年会上公布了一项多中心、随机对照研究结果7,也证实了在MDS伴原始细胞增多(MDS-EB)患者中,ATRA联合地西他滨治疗较地西他滨单药治疗拥有更高的缓解率和更长的无进展生存期(PFS)。结果显示,中位随访30.1个月,ATRA+地西他滨组的ORR(78% vs. 51%,P<0.001)和CR率(23% vs. 12%,P=0.042)均显著高于地西他滨单药组,且PFS显著延长,分别为14.9个月和10.5个月(P=0.032)。
此外,使用ATRA+阿扎胞苷+丙戊酸联合方案治疗HR-MDS/AML患者8,总缓解率为42%,在既往未接受过治疗的老年患者中总缓解率为52%,中位缓解持续时间为26周,在4例HR-MDS患者中,2例患者达到CR,2例达到骨髓缓解。
值得注意的是,目前国内首个ATRA胶囊剂型已获批上市,通过剂型的升级,相较于片剂,其在稳定性、生物利用度和 安全性等方面展现出较大优势,为MDS患者带来更优治疗选择。
安全性等方面展现出较大优势,为MDS患者带来更优治疗选择。
总体而言,本例患者确诊为HR-MDS,入院后先后接受地西他滨、阿扎胞苷+CAG方案治疗,因化疗后骨髓抑制合并感染改用ATRA联合阿扎胞苷治疗,患者原始细胞比例降至3%,血象(WBC、Hb、PLT)均明显改善,输血需求减少且耐受性良好,目前已持续治疗2年5个月。从初次接诊时的焦虑,到如今复查时能坦然讨论血象结果,7年病程里,每一次治疗调整,都是医患在病历单上共同画下的“逗号”,让医学不仅是对抗疾病的武器,更成为托举生命尊严的力量。

李正发 教授
主任医师,教授,硕导
云南省“省突”
云南省“云岭名医"
云南省第一人民医院血液内科副主任
新昆华医院血液内科主任
昆明市血液淋巴疾病临床医学中心主任
云南省血液疾病临床医学学术带头人
中国中西医结合学会血液专业委员会委员
中国临床肿瘤学会白血病专家委员会委员
云南省转化医学会淋巴瘤 专委会副主任委员
专委会副主任委员
云南省综合评标(医药)专家委员会委员
云南省抗癌协会小儿肿瘤专委会常委
云南省抗癌协会血液学专业委员会委员
云南省医学会血液学专业委员会委员
第一完成人获部省科技进步奖二、三等6 项;获省卫生科技成果奖一、二、三等奖7项。负责人国自然科学基金、省科学基金13项。第一作者/通讯作者SCI、CA、SSCI、ISTIC、CSCD论文72篇。《中国组织工程研究》;CURRENT STEM CELL RESEARCH & THERAPY.《生命科学研究》编委及审稿人

