
肺凡案例 | 余慧青、张均辉教授:罕见且棘手的临床挑战——1例肺NUT癌的诊治
伴睾丸核蛋白(nuclear protein in testis,NUT)基因重排的中线癌又称NUT癌,是一种与NUT中线癌家族成员1(NUT midline carcinoma family member1,NUTM1)基因(位于15号染色体长臂)重排相关,罕见且具有高度侵袭性的恶性肿瘤。
NUT癌临床上缺乏深度认识,诊断与治疗规范缺乏统一性。重庆大学附属肿瘤医院余慧青教授、张均辉教授分享并点评了一例肺NUT癌病例,旨在提高临床医生对肺NUT癌的认知,从而促进疾病的早诊早治。
一般资料
患者男性,48岁,因“咳嗽、咳痰1+年”于2023年3月入院。2021年10月因“发热、咳嗽、咳痰”就诊,完善胸部CT平扫示左肺下叶团块状软组织密度影,大小约7.0*9.2cm,性质待定,经补液抗感染治疗后病情好转,未行进一步诊治。2022年6月因咳嗽、咳痰明显加重入院,纤支镜活检提示低分化癌,倾向小细胞癌。免疫组化病理诊断符合(左肺下叶)NUT癌。既往无高血压、糖尿病等慢性病史,否认肺结核、外伤、手术治疗史;有20+年吸烟史,20+支/天;有20+年饮酒史,150-200g/天,无肿瘤家族史。
入院诊疗过程
检查
实验室检查
2022年6月肿瘤标志物:癌胚抗原CEA 3.92ng/ml,糖类抗原CA19-9 19.33U/ml,CA125 66.86U/ml↑,CA72-4 6.9U/ml,CA242 10.02U/ml↑,非小细胞肺癌抗原CYFRA211 1.38ng/ml,铁蛋白FER 600ng/ml↑,神经元特异性烯醇化酶NSE 9.84ng/ml,鳞状上皮细胞癌抗原SCCA 1.64ng/ml。
影像学检查
①2022-06-21(左肺下叶)纤支镜活检(脱落细胞学+病理):查见低分化癌,倾向小细胞癌(图1)。
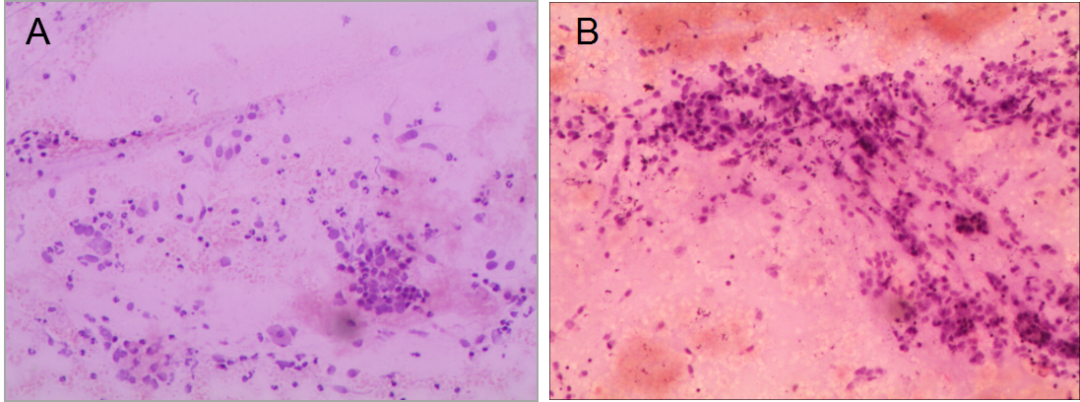
图1 纤支镜活检病理结果(HE:200×) A为脱落细胞学检查;B为组织活检病理
②2022-07-20外院病理会诊-免疫组化:CK(+),P40(+),TTF-1(-),CD56(-),CgA(-),Syn(+/-),K1-67(+,30%),P63(+),NUT-1(+,75%细胞核颗粒状阳性),EMA(+),LCA(-),SMACA4(BRG+)。结合免疫组化结果,符合(左肺下叶)NUT癌。
③胸部靶病灶的影像学(CT)变化:患者左下肺占位初治时大小为7.0cm*9.2cm,给予IP/IC方案化疗后逐渐缩小至1.5cm*1.0cm,接着给于同步放化疗,靶病灶未见明显缩小或增大。2023年3月5日复查胸部CT提示左肺下叶斑片状高密度影,大小约3.5cm*4.3cm,邻近支气管狭窄;右肺中叶小结节,直径约3mm,随诊;双肺散在纤维灶;双侧胸膜增厚;胸椎骨质增生(图2)。
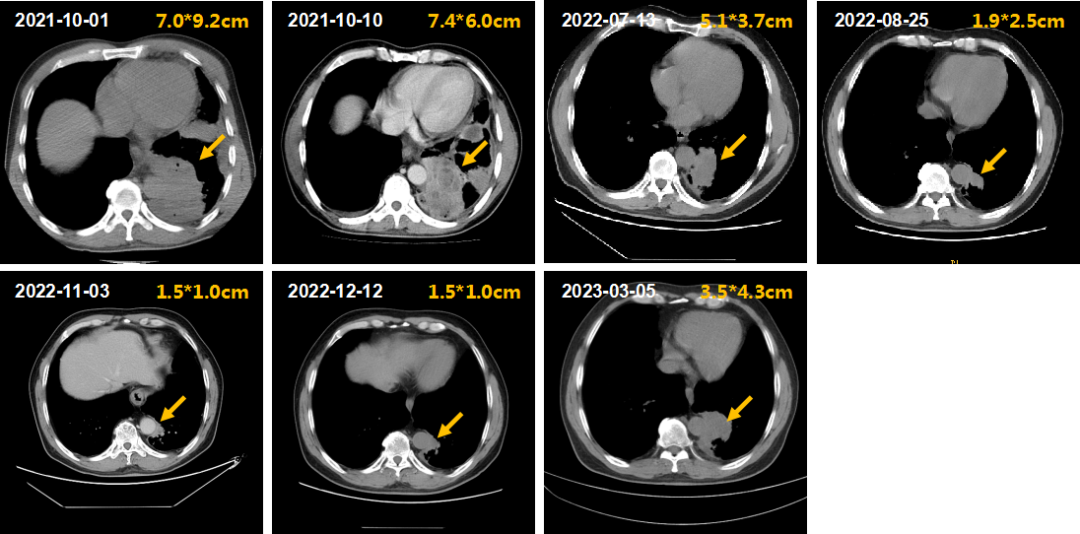
图2.患者肺部靶病灶的CT改变
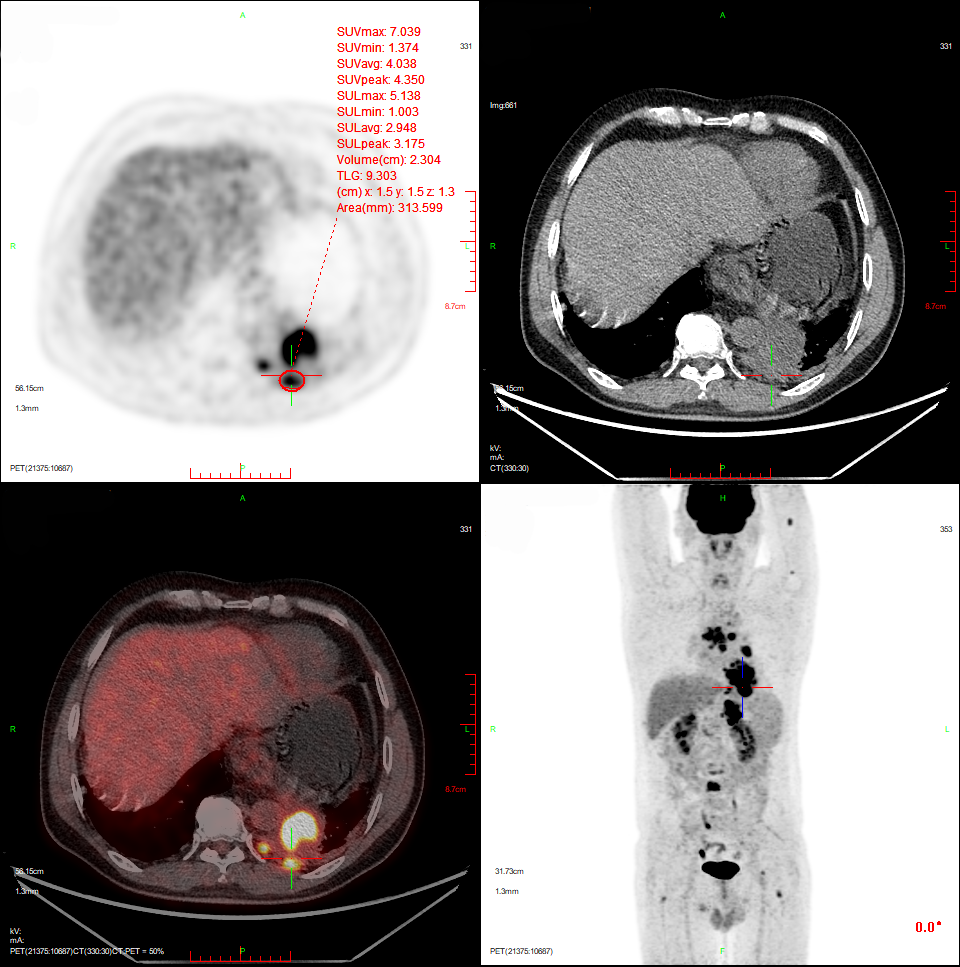
图3.患者PET/CT检查
诊断与鉴别诊断
左肺下叶恶性肿瘤(NUT癌,cT3N2M1,Ⅳ期);
纵隔淋巴结继发恶性肿瘤;
骨继发恶性肿瘤。
治疗
患者因“咳嗽、咳痰”加重,完善纤支镜活检,提示低分化癌,倾向小细胞癌,排除化疗禁忌症,遂行IP(伊立替康+顺铂)化疗,咳嗽、咳痰症状缓解,完成4个周期IP方案化疗,中途出现恶心、呕吐、骨髓抑制、白细胞减少,给于止吐、升白细胞等对症支持治疗,按照《RECIST 实体瘤疗效评价标准(1.1 版)》进行疗效评价:部分缓解(PR)。
2022年07月20日外院病理会诊,免疫组化提示左肺下叶NUT癌。因该患者IP方案治疗有效,考虑继续维持该方案化疗。由于当时医院药房顺铂缺药,排除禁忌症,于2022-09-20、2022-10-12行2个周期IC(伊立替康+卡铂)方案化疗,靶病灶继续缩小。
排除放疗禁忌症,2022-11-04行胸部病灶放疗联合顺铂化疗,胸部病灶共计放疗量:(6000cGy/30f),疗效评价:PR。
于2023-03-05门诊复查胸部CT示左肺下叶斑片状高密度影,大小约3.5cm*4.3cm,考虑肿瘤进展,排除禁忌症,于2023-03-06行EP(依托泊苷+顺铂)方案化疗。
因全身疼痛不适,NRS 5分,镇痛效果不佳,于2023-03-21行PET/CT检查提示:1.左肺下叶软组织肿块6.6cm*7.3cm代谢性增高,考虑治疗后活性存在伴阻塞性肺炎;2.纵膈及左肺门、腹膜后、左侧膈脚后淋巴结转移;3.左侧胸膜转移,第5胸椎周围软组织增厚,考虑转移,后方椎管受侵;4.全身多发骨转移,脊柱退变;5.右肺上叶尖段炎性小结节。
经多学科讨论后,考虑疾病进展,排除相关禁忌症后于2023-03-27行卡瑞利珠单抗联合TC方案(紫杉醇+卡铂)化疗,同时建议行第5胸椎病灶的局部治疗,患方拒绝。
患者于末次出院后不久出现双下肢瘫痪,终止抗癌治疗。在整个抗癌治疗过程中给予营养支持、镇痛、止咳化痰、升血小板、升白细胞等最佳支持治疗。
治疗结果、随访及转归
患者通过经化疗、同步放化疗、免疫治疗联合化疗、最佳支持治疗等综合治疗,总生存期(OS)达到近24个月(图4)。
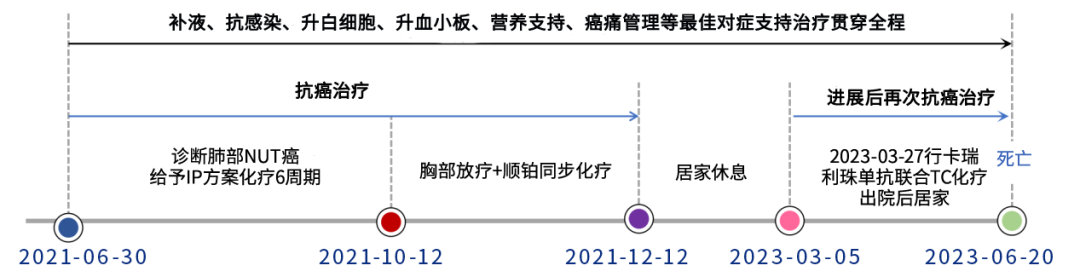
图4.治疗过程及转归
讨论
肺癌是中国和全世界癌症相关死亡的主要原因,约占癌症相关死亡人数的20%[1]。近年来,分子检测和免疫组织化学技术的迅速发展,进一步开创了肺癌个体化治疗的时代。肺NUT癌仅占肺恶性肿瘤的0.6%[2],是一种由NUT基因重排定义的低分化的、高度侵袭性的癌症,其组织病理学特征主要为低分化细胞伴局灶性鳞状分化,免疫组织化学染色NUT表达呈阳性。肺NUT癌好发于青壮年,平均年龄为42-48岁[2]。大多数情况下,晚期肺NUT癌患者接受化疗或放化疗后,无明显获益[3]。肺NUT癌预后极差,中位总生存期为2.2-2.75个月[4, 5]。
由于肺NUT癌高度侵袭性,大多数患者被诊断时为晚期,失去了手术治疗的机会。由于其罕见性,目前肺NUT癌没有标准治疗方法,也很少被纳入靶向治疗的临床试验[6]。该例患者纤支镜活检的初步报告考虑为低分化、小细胞癌,根据最新肺癌诊治指南给予IP/IC方案化疗6个周期,靶病灶显著缩小,咳嗽、咳痰症状缓解,同步放化疗患者病情稳定,后线给予免疫治疗联合化疗,总体取得不错的疗效,总体治疗时间较长。
从发病机制上看,NUT癌主要由BRD3/4-NUT融合驱动:BET家族的丝氨酸激酶BRD4通过其溴结构域与染色质结合,NUT募集p300/CBP来驱动致癌基因的转录,从而进一步阻断NUT癌细胞的分化[7]。NUT还与更罕见的对应基因(如NSD3、ZNF532或CHRM5)融合,最终这些基因倾向于与BRD4相互作用,从而产生类似的致癌作用[8]。因此,BET抑制剂(BETi)被认为是潜在的肺NUT癌治疗药物。例如,在接受Birabresib(一种靶向BRD2、BRD3和BRD4的合成小分子)治疗的4例患者中,2例肺NUT癌患者获得了显著的长期生存(分别为19个月和18个月);高选择性BETis,如Molibresi/GSK525762和RO6870810/TEN-010,使肺NUT癌患者获得显著疗效和延长生存期,同时减少了血小板减少症和中性粒细胞减少症等毒副反应的发生[9,10]。此外有研究发现,组蛋白去乙酰化酶(HDACs)对BRD4与启动子相结合至关重要,肺NUT癌在PI3K/AKT通路中存在非同义突变,如PIK3CA、PIK3R1、PTEN和ERBB4。1例经CUDC-907 (HDAC/PI3K双抑制剂)后线治疗的NUT癌患者,病情稳定(SD)超过32个月。因此,HDAC和PI3K/AKT通路是肺NUT癌的潜在治疗靶点。


