
王坤教授:中国力量赋能HER2阳性乳腺癌新辅助治疗,推动“降阶梯”治疗时代浪潮
2025年美国临床肿瘤学会(ASCO)年会上,备受瞩目的neoCARHP研究以重磅口头报告(LBA)形式惊艳亮相。这项针对HER2阳性早期乳腺癌 的国际多中心Ⅲ期研究,聚焦新辅助治疗领域,将当前标准的TCbHP方案(曲妥珠单抗
的国际多中心Ⅲ期研究,聚焦新辅助治疗领域,将当前标准的TCbHP方案(曲妥珠单抗 +帕妥珠单抗
+帕妥珠单抗 +紫杉类+卡铂
+紫杉类+卡铂 )作为对照,头对头比较了豁免卡铂的临床价值,结果显示,不含卡铂的THP方案(紫杉烷+曲妥珠单抗+帕妥珠单抗)在病理完全缓解率(pCR)方面达到了预设的非劣效终点,与标准含卡铂方案疗效相当,同时显著降低了血液学等严重不良事件的发生率1。这一突破性发现为HER2阳性乳腺癌患者带来了更安全的治疗选择,不仅推动了治疗模式向“精准降阶梯”转变,更深刻体现了以患者生活质量为核心的个体化诊疗理念。作为中国学者主导的标志性研究,neoCARHP研究为乳腺癌治疗提供了关键证据,并为进一步探索免化疗策略奠定了重要基石。
)作为对照,头对头比较了豁免卡铂的临床价值,结果显示,不含卡铂的THP方案(紫杉烷+曲妥珠单抗+帕妥珠单抗)在病理完全缓解率(pCR)方面达到了预设的非劣效终点,与标准含卡铂方案疗效相当,同时显著降低了血液学等严重不良事件的发生率1。这一突破性发现为HER2阳性乳腺癌患者带来了更安全的治疗选择,不仅推动了治疗模式向“精准降阶梯”转变,更深刻体现了以患者生活质量为核心的个体化诊疗理念。作为中国学者主导的标志性研究,neoCARHP研究为乳腺癌治疗提供了关键证据,并为进一步探索免化疗策略奠定了重要基石。
值此契机,医脉通诚挚邀请广东省人民医院王坤教授,就neoCARHP研究的背景及意义分享真知灼见,并展望未来HER2阳性乳腺癌诊疗的发展前景,以期为临床实践提供个体化、精准化的指导。

Q1:您牵头的neoCARHP研究入选2025年ASCO年会LBA,探索了HER2阳性乳腺癌新辅助治疗“去卡铂”策略的疗效和安全性。当前,TCbHP方案是国际标准,能否请您谈谈,为何您和团队选择此时探索“去卡铂”的降阶梯治疗策略?其临床需求背景及考量是什么?
王坤教授:
在Ⅱ-Ⅲ期的HER2阳性早期乳腺癌的治疗中,新辅助治疗已成为标准推荐方案,国内外权威指南均一致推荐将TCbHP方案作为早期HER2阳性乳腺癌新辅助治疗的首选方案2。然而,尽管TCbHP方案能带来相对较高的pCR3,在临床中得到了广泛应用,但在临床实践中,卡铂所致的不良事件仍不容忽视,包括中性粒细胞减少等血液学毒性,以及恶心、呕吐 等消化道毒性等4。这些不良事件不仅可能导致部分患者治疗减量、延迟,甚至被迫中断治疗,严重影响了治疗的依从性和患者的生活质量。因此,“降阶梯”作为近年来HER2阳性乳腺癌新辅助治疗的重要探索方向之一,其核心在于在保证疗效的前提下,减少治疗毒性以提升患者耐受性,这也正是我们探索“去卡铂”方案的初衷。
等消化道毒性等4。这些不良事件不仅可能导致部分患者治疗减量、延迟,甚至被迫中断治疗,严重影响了治疗的依从性和患者的生活质量。因此,“降阶梯”作为近年来HER2阳性乳腺癌新辅助治疗的重要探索方向之一,其核心在于在保证疗效的前提下,减少治疗毒性以提升患者耐受性,这也正是我们探索“去卡铂”方案的初衷。
曲妥珠单抗与帕妥珠单抗的双重HER2阻断为这一探索提供了重要基础。从作用机制来看,曲妥珠单抗和帕妥珠单抗联合使用可以从不同结构域阻断HER2信号通路,增强下游信号传导的阻断效应,同时,二者可共同发挥抗体依赖的细胞介导的细胞毒作用,从而增强免疫协同效应,更全面地抑制肿瘤细胞的生长、增殖和存活,为安全“降阶梯”奠定了坚实的基础。
与此同时,既往的循证医学证据也为“降阶梯”提供了重要启示。BCIRG 007研究显示5,在HER2阳性晚期乳腺癌患者中,在多西他赛 联合曲妥珠单抗的基础上加用卡铂(TCbH方案),与单纯的多西他赛联合曲妥珠单抗(TH方案)相比,在客观缓解率、疾病进展时间(TTP)和总生存期(OS)上并未显示出显著优势。这提示卡铂在HER2阳性乳腺癌治疗中的增效作用可能并非不可或缺。
联合曲妥珠单抗的基础上加用卡铂(TCbH方案),与单纯的多西他赛联合曲妥珠单抗(TH方案)相比,在客观缓解率、疾病进展时间(TTP)和总生存期(OS)上并未显示出显著优势。这提示卡铂在HER2阳性乳腺癌治疗中的增效作用可能并非不可或缺。
上述因素共同促进了一项多中心、开放标签、随机、非劣效性的Ⅲ期临床研究——neoCARHP研究的开展,旨在评估TCbHP和不联合卡铂的THP方案在HER2阳性早期乳腺癌患者中的疗效和安全性1,以期优化HER2阳性乳腺癌患者的新辅助治疗策略,为治疗方案的选择提供有价值的参考。
Q2:此次neoCARHP研究的公布,备受国内外乳腺癌领域专家学者的关注和好评,一致认为该研究结果或将为HER2阳性乳腺癌临床实践带来重大影响。neoCARHP研究的一大亮点是THP对比TCbHP方案达到非劣效pCR率(64.1% vs 65.9%),P值为0.0089,以及良好的安全性。能否请您谈谈,该研究对HER2阳性乳腺癌临床实践带来怎样的核心启示?
王坤教授:
neoCARHP研究的公布在乳腺癌领域引起了广泛关注,其结果对HER2阳性乳腺癌的临床实践具有重要的启示意义。从疗效来看,THP组与TCbHP组相比,pCR率的绝对差异仅为-1.8%(95%CI:-8.5~5.0),且非劣效性检验的P值达到0.00891(图1)。这一结果证实,在曲妥珠单抗联合帕妥珠单抗的双重HER2阻断基础上省略卡铂,并不会影响新辅助阶段的治疗效果,THP方案能够稳定地为患者带来与标准方案相当的肿瘤缓解效果。
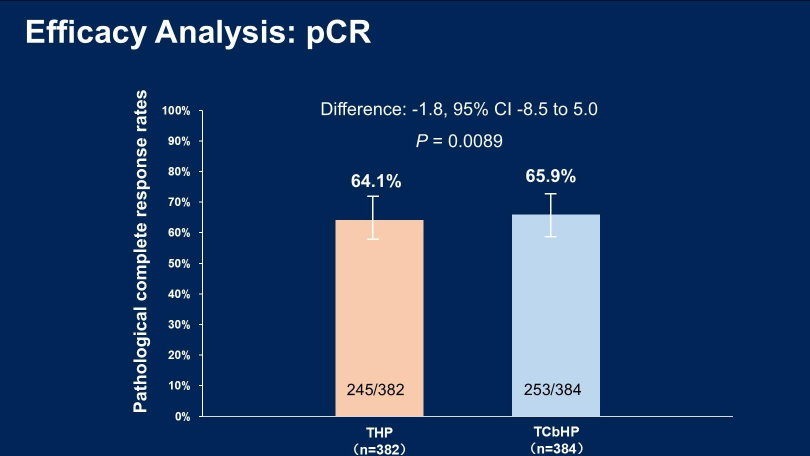
图1 neoCARHP研究:pCR率
而在安全性方面,THP组同样表现出色,其3~4级不良事件的发生率较TCbHP组降低了13.9%(20.7% vs 34.6%),严重不良事件发生率也更低(1.3% vs 4.7%)1。尤其值得关注的是,患者常受困扰的血液学不良事件在THP方案治疗中的发生率更低。例如,严重的中性粒细胞减少在THP组的发生率仅为6.8%,远低于TCbHP组的16.4%;THP组严重的白细胞减少发生率也更低(5.5% vs 14.8%)(图2)1。此外,其他与卡铂相关的副作用,如贫血 、血小板减少,以及恶心呕吐、腹泻
、血小板减少,以及恶心呕吐、腹泻 等消化道反应,甚至肾脏负担加重等问题,在THP组的发生率均低于TCbHP组1。这种安全性的提升,意味着患者因不良反应导致治疗减量、延迟或中断的情况将大大减少。这不仅提高了治疗的依从性,还切实改善了患者的生活质量,为患者带来了兼顾疗效与安全性的全新选择。
等消化道反应,甚至肾脏负担加重等问题,在THP组的发生率均低于TCbHP组1。这种安全性的提升,意味着患者因不良反应导致治疗减量、延迟或中断的情况将大大减少。这不仅提高了治疗的依从性,还切实改善了患者的生活质量,为患者带来了兼顾疗效与安全性的全新选择。
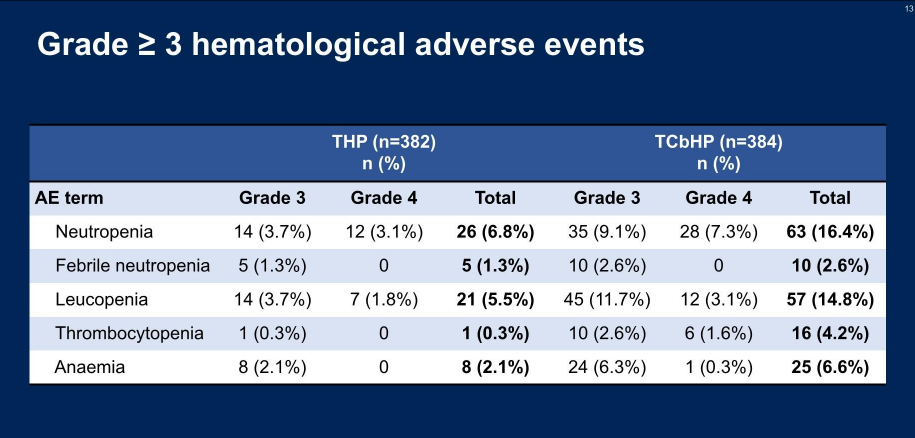
图2 neoCARHP研究:安全性数据
从临床实践角度来看,neoCARHP研究推动了HER2阳性乳腺癌治疗范式向“精准降阶梯”转变。对于需要接受新辅助治疗但疾病负荷相对较小或耐受力相对较差的患者,THP方案在保证疗效的前提下,通过“去卡铂”的方式,减少了不必要的治疗负担,既体现了“以患者为中心” 的个体化诊疗理念,也有望在未来临床实践中优化治疗模式,降低不良事件对患者生活质量的影响,为患者带来更多治疗选择和更好的治疗体验。
Q3:neoCARHP研究初步证实了HER2阳性乳腺癌新辅助治疗“去卡铂”的可行性,能否请您分享,未来还有哪些研究方向值得期待?会否进一步探索豁免化疗策略?在“精准治疗”的时代背景下,应如何通过生物标志物实现更精准的“降阶梯”治疗?
王坤教授:
neoCARHP研究的初步成果为HER2阳性乳腺癌新辅助治疗的“去卡铂”双靶治疗方案提供了有力的证据,不仅为当前的治疗模式带来了新的思路,也为未来的研究方向开辟了新的视野。在未来的探索中,有几个重要的研究方向值得期待:
首先,双靶治疗作为“降阶梯”治疗的坚实基石,其潜力已在neoCARHP研究中得到了初步证实,为后续探索更简化的治疗方案奠定了重要基础。未来,可以进一步探索免化疗的新辅助治疗方案,通过对不同风险人群分层,对极低危患者可尝试双靶单药以实现完全豁免化疗;同时,可尝试根据患者的治疗反应动态调整方案,逐步降低化疗强度。
其次,在精准治疗的时代背景下,生物标志物的应用是实现更精准“降阶梯”治疗的关键,目前已有多个方向展现出探索价值。例如磷脂酰肌醇 4,5-二磷酸3-激酶催化亚基α(PIK3CA)基因突变在HER2阳性晚期乳腺癌中已具有明确的预测意义6,为精准治疗提供了关键依据,但对于早期乳腺癌,其预测价值仍需要深入探究。同时,肿瘤浸润淋巴细胞(TILs)等其他生物标志物的应用前景也备受关注7,未来需通过大规模、多中心的临床研究进一步验证其临床意义。相信随着研究的不断深入,我们有望借助这些生物标志物不断完善个体化治疗决策体系,最终推动乳腺癌精准治疗迈向新台阶。
4,5-二磷酸3-激酶催化亚基α(PIK3CA)基因突变在HER2阳性晚期乳腺癌中已具有明确的预测意义6,为精准治疗提供了关键依据,但对于早期乳腺癌,其预测价值仍需要深入探究。同时,肿瘤浸润淋巴细胞(TILs)等其他生物标志物的应用前景也备受关注7,未来需通过大规模、多中心的临床研究进一步验证其临床意义。相信随着研究的不断深入,我们有望借助这些生物标志物不断完善个体化治疗决策体系,最终推动乳腺癌精准治疗迈向新台阶。
此外,结合影像组学和循环肿瘤DNA(ctDNA)的动态监测等方法,有望构建更为精准的疗效预测模型。影像组学可以通过分析肿瘤的影像特征来提供关于肿瘤生物学行为的信息,而ctDNA动态监测则能够实时反映肿瘤的基因变化。通过整合这些多维度的信息,医生可以更准确地评估患者的治疗反应,并根据治疗过程中的动态变化调整治疗强度,实现真正的精准治疗。
总体而言,在精准治疗时代,我们的目标不仅是治愈乳腺癌,更要让患者在治疗过程中保持良好的生活质量。neoCARHP研究无疑是这一征程中的重要“里程碑”,未来的研究方向不仅需要探索新的治疗组合和药物,更应聚焦于如何借助生物标志物和新兴技术实现治疗的精准化与个体化。这将有助于进一步优化HER2阳性乳腺癌的治疗策略,为患者提供更安全、更有效的治疗方案,同时减轻不必要的治疗负担和不良事件,最终推动HER2阳性乳腺癌的治疗向更精准、更个体化的方向持续迈进。

