
临研寻药 | ARPI治疗后进展?面对mCRPC治疗困境——谁是下一个“破局者”?
经雄激素受体通路抑制剂(ARPI)治疗后仍进展的转移性去势抵抗性前列腺癌 (mCRPC)患者,预后普遍较差,总生存期通常不足两年;若合并盆腔外软组织转移(特别是肝转移),中位总生存期仅约一年。当前亟需为ARPI失败后进展的mCRPC患者开发兼具新机制、高安全性和确切疗效的治疗方案。
(mCRPC)患者,预后普遍较差,总生存期通常不足两年;若合并盆腔外软组织转移(特别是肝转移),中位总生存期仅约一年。当前亟需为ARPI失败后进展的mCRPC患者开发兼具新机制、高安全性和确切疗效的治疗方案。
多靶点酪氨酸激酶抑制剂卡博替尼(靶点:VEGFR、MET及TAM家族TYRO3/AXL/MER)已被获批单药用于晚期肾细胞癌 、肝细胞癌
、肝细胞癌 和分化型甲状腺癌
和分化型甲状腺癌 ,并与纳武利尤单抗
,并与纳武利尤单抗 联合用于晚期肾癌
联合用于晚期肾癌 一线治疗。然而,在Ⅲ期COMET-1研究(N=1028)中,卡博替尼单药未能显著延长既往接受ARPI及多西他赛
一线治疗。然而,在Ⅲ期COMET-1研究(N=1028)中,卡博替尼单药未能显著延长既往接受ARPI及多西他赛 、伴骨转移mCRPC患者的总生存期(HR:0.90,P=0.21);仅在内脏转移亚组(n=191)观察到非显著获益趋势(HR:0.77,95% CI:0.54–1.09)。免疫检查点抑制剂(如PD-L1抑制剂阿替利珠单抗
、伴骨转移mCRPC患者的总生存期(HR:0.90,P=0.21);仅在内脏转移亚组(n=191)观察到非显著获益趋势(HR:0.77,95% CI:0.54–1.09)。免疫检查点抑制剂(如PD-L1抑制剂阿替利珠单抗 )在前列腺癌中也未显示活性,可能与肿瘤免疫抑制微环境有关。基于此,Lancet Oncology期刊发表了一篇标题为“Cabozantinib plus atezolizumab in metastatic prostate cancer (CONTACT-02): final analyses from a phase 3, open-label, randomised trial的研究,该研究旨在评估卡博替尼联合阿替利珠单抗在mCRPC伴盆腔外软组织转移患者中的疗效与安全性。医脉通现整理如下,以飨读者。
)在前列腺癌中也未显示活性,可能与肿瘤免疫抑制微环境有关。基于此,Lancet Oncology期刊发表了一篇标题为“Cabozantinib plus atezolizumab in metastatic prostate cancer (CONTACT-02): final analyses from a phase 3, open-label, randomised trial的研究,该研究旨在评估卡博替尼联合阿替利珠单抗在mCRPC伴盆腔外软组织转移患者中的疗效与安全性。医脉通现整理如下,以飨读者。

研究背景
伴有盆腔外软组织转移的mCRPC患者,若经ARPI治疗后发生疾病进展,其预后较差且治疗选择有限。该研究旨在评估具有免疫调节特性的酪氨酸激酶抑制剂卡博替尼,联合PD-L1抑制剂阿替利珠单抗在此类患者中的疗效与安全性。
研究方法
CONTACT-02是一项开放标签、随机化的Ⅲ期研究,在24个国家(涵盖欧洲、北美、亚太及拉丁美洲)的184个研究中心开展。研究纳入年龄≥18岁、美国东部肿瘤协作组(ECOG)体力状态评分为0或1分、伴有可测量盆腔外软组织转移(淋巴结或内脏转移)且经一种ARPI治疗后进展的mCRPC男性患者。
患者通过基于网络的交互式响应技术系统按 1:1 的比例随机分配至两组,一组接受卡博替尼(40mg,每日一次口服)联合阿替利珠单抗(1200mg,每 3 周一次静脉注射)治疗,另一组接受ARPI转换治疗(阿比特龙 1000mg 每日一次口服联合泼尼松
1000mg 每日一次口服联合泼尼松 5mg 每日两次口服,或恩扎卢胺
5mg 每日两次口服,或恩扎卢胺 160mg 每日一次口服)。随机分层因素包括:是否存在肝转移、既往是否接受过多西他赛治疗、首次使用 ARPI 时的疾病状态。
160mg 每日一次口服)。随机分层因素包括:是否存在肝转移、既往是否接受过多西他赛治疗、首次使用 ARPI 时的疾病状态。
双重主要终点为:前400例随机分配患者(无进展生存期意向性治疗人群)的无进展生存期,以及所有随机分配患者(意向性治疗人群)的总生存期。安全性评估对象为所有至少接受过一剂研究治疗的患者。尽管该研究仍在进行中(部分患者仍在随访),但本次分析为方案规定的最终分析。
研究结果
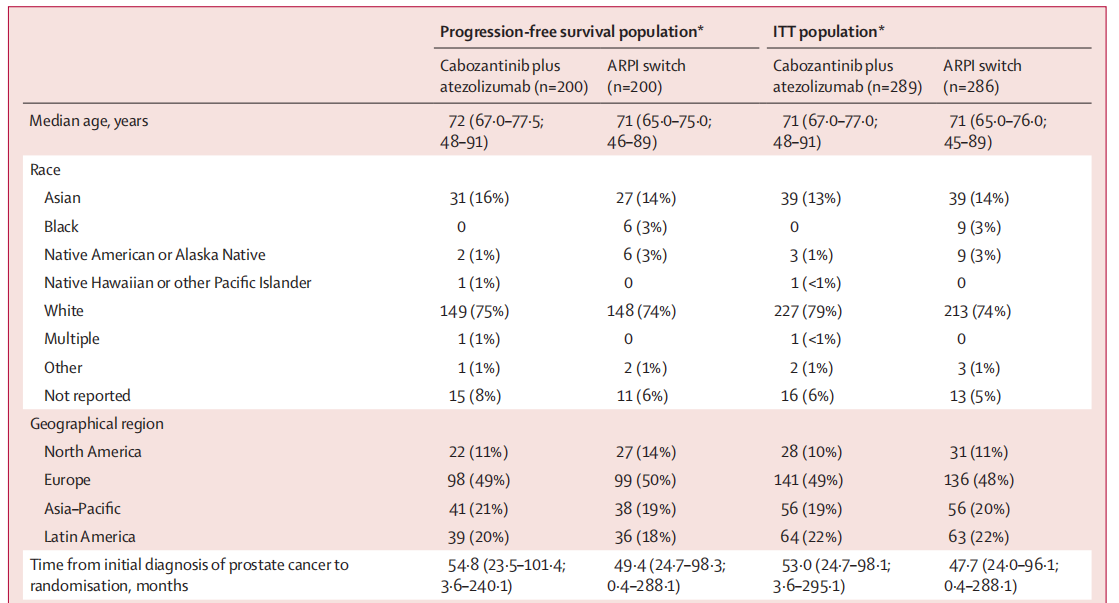
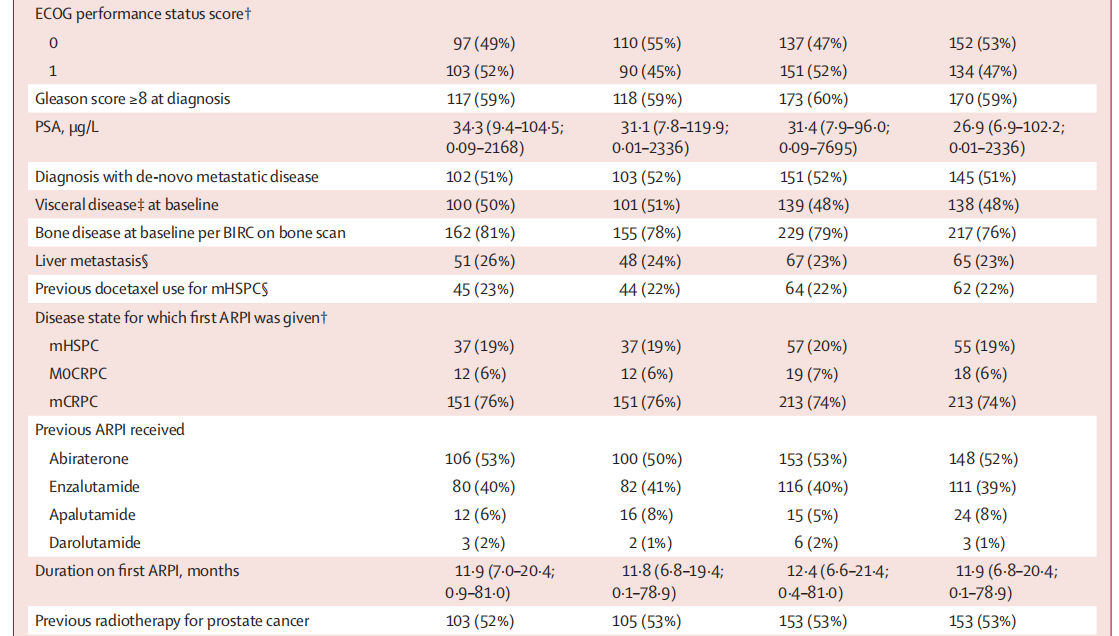
2020年8月20日至2023年6月7日期间,共575例患者被随机分配至卡博替尼联合阿替利珠单抗组(n=289)或ARPI转换组(n=286)。基线特征详见表1。
表1.患者基线特征

中位随访11.8个月(IQR 9.9-19.3)后,卡博替尼联合阿替利珠单抗组较ARPI转换组显著改善患者无进展生存期(中位数6.3个月[95% CI:6.2-8.8] vs 4.2个月[95%CI:0.50-0.84],P=0.0007)(图1A)。
在预先设定的各患者亚组中,卡博替尼联合阿替利珠单抗带来的无进展生存期获益与主要分析结果一致,这些亚组包括:无论首次 ARPI 是用于转移性去势敏感性前列腺癌(mHSPC)还是mCRPC的患者(图 1B)、存在肝转移的患者(图 1C)、既往接受过多西他赛治疗的患者(图 1D)以及存在骨转移的患者(图 1E)。
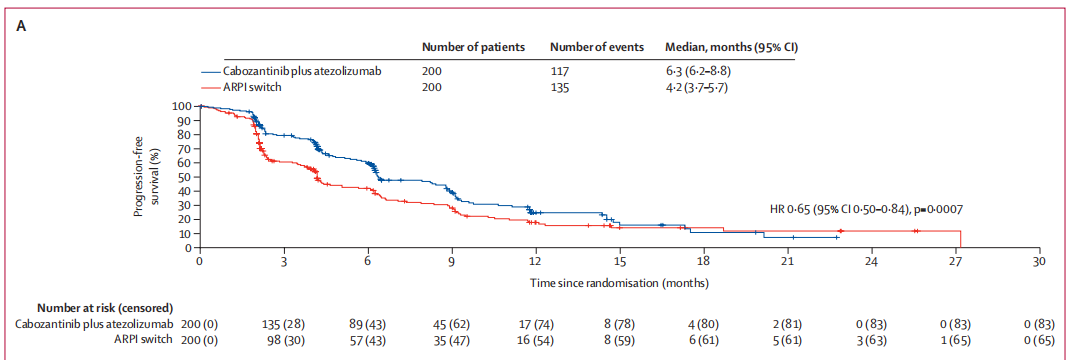
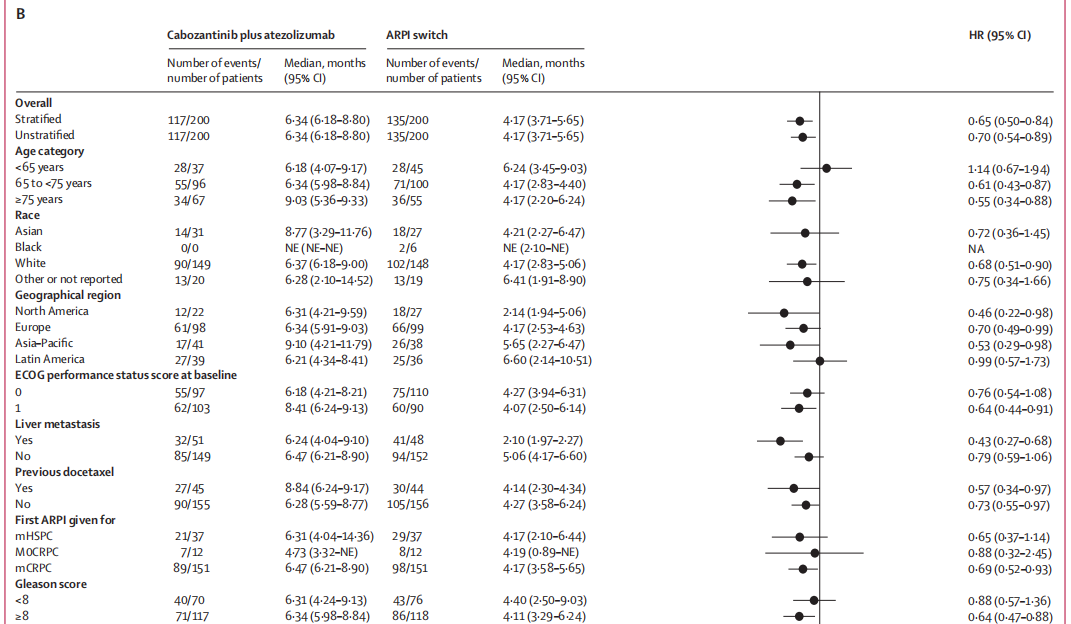

图 1:无进展生存期(A)无进展生存期人群。(B)预先设定的亚组。(C)伴有肝转移的患者。(D)既往接受过多西他赛治疗的患者。(E)伴有骨转移的患者。
BIRC = 盲态独立影像评估委员会;ECOG = 东部肿瘤协作组;HR = 风险比;mCRPC = 转移性去势抵抗性前列腺癌;nmCRPC = 非转移性去势抵抗性前列腺癌;mHSPC = 转移性去势敏感性前列腺癌;NA = 不适用;NE = 无法估计;PSA = 前列腺特异性抗原 。
。
最终总生存期分析显示,与 ARPI 转换治疗相比,卡博替尼联合阿替利珠单抗并未带来显著获益(卡博替尼联合阿替利珠单抗组的中位总生存期为14.8个月 [95% CI:13.4-16.7],ARPI 转换治疗组为 15.0 个月 [95% CI:0.72-1.10],P=0.30;图 2A)。
在预先设定亚组的探索性分析中,大多数亚组中卡博替尼联合阿替利珠单抗与 ARPI 转换治疗的总生存期相近,但在伴有肝转移的患者中,HR为0.68(95% CI:0.47-1.00),卡博替尼联合阿替利珠单抗组的中位总生存期为12.2个月,而ARPI转换治疗组为7.1个月(图 2B)。
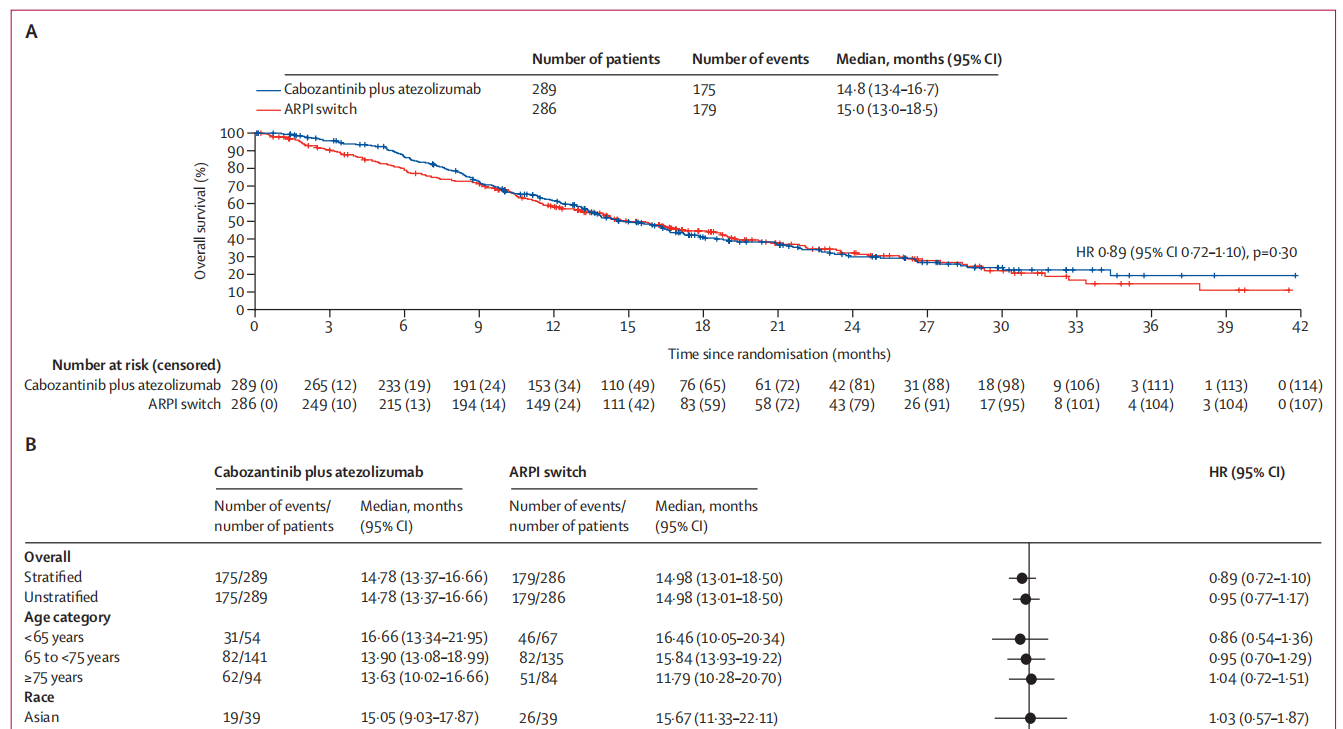

图2.总生存期(A)意向性治疗人群。(B)预先设定的亚组。
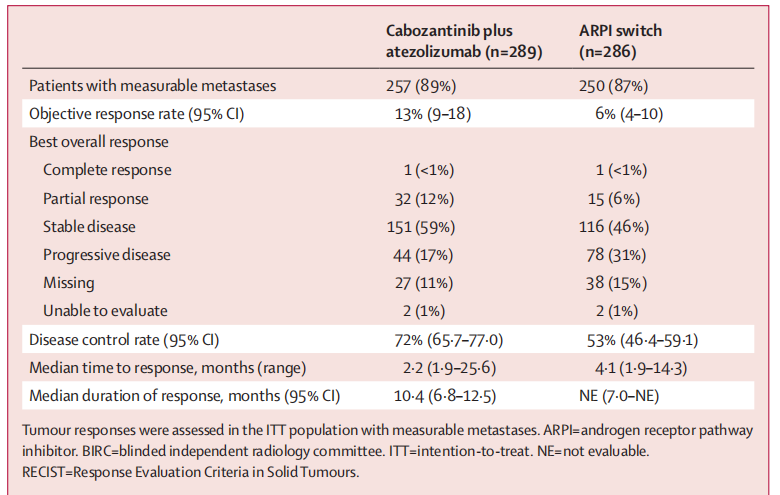
根据盲态独立影像评估委员会(BIRC)的评估结果,在基线时有可测量转移灶的意向性治疗(ITT)人群中:卡博替尼联合阿替利珠单抗组的客观缓解率(13%;95% CI:9-18)高于ARPI转换治疗组(6%;95% CI:4-10);卡博替尼联合阿替利珠单抗组的疾病控制率(72%)高于ARPI转换治疗组(53%);卡博替尼联合阿替利珠单抗组中最佳疗效为疾病进展的患者更少(17% vs 31%;表 2);且卡博替尼联合阿替利珠单抗组中肿瘤缩小的患者多于 ARPI 转换治疗组(68% vs 37%)。
表2. 根据BIRC采用实体瘤疗效评价标准(RECIST,1.1 版)评估的肿瘤缓解情况
卡博替尼联合阿替利珠单抗组的中位症状性骨事件发生时间为24.0个月(95% CI:16.3-无法估计),ARPI转换治疗组为17.3个月(95%CI:13.2-无法估计);卡博替尼联合阿替利珠单抗组的中位化疗启动时间为19.6个月(95% CI:16.2-26.9),ARPI转换治疗组为10.4个月(95% CI:8.3-15.3)(P<0.0001)。 两组的PSA应答率相近(卡博替尼联合阿替利珠单抗组:14%;ARPI转换治疗组:15%);欧洲癌症研究与治疗组织生活质量核心问卷(EORTC QLQ-C30)总体健康状况恶化的中位时间也相近(卡博替尼联合阿替利珠单抗组4.1个月[95% CI:2.6-4.2],ARPI转换治疗组4.2个月[95% CI:3.0-4.3)。
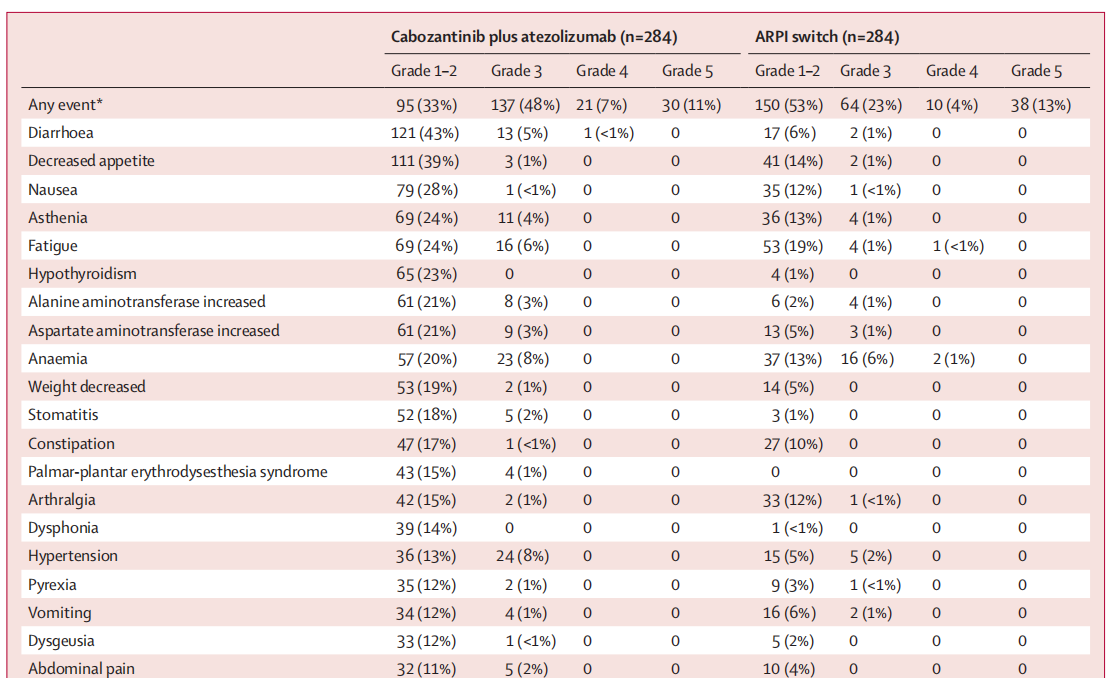
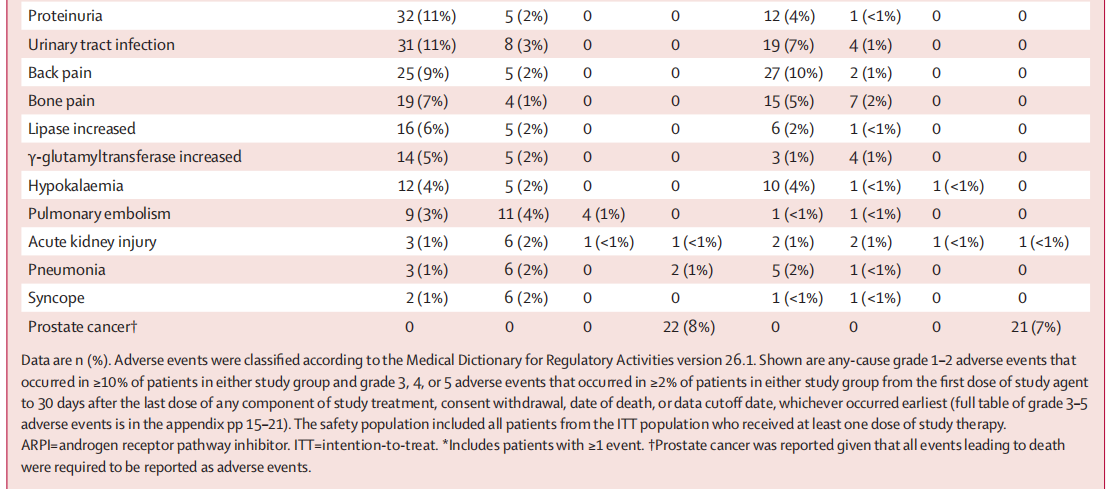
在安全性人群中,卡博替尼联合阿替利珠单抗组与 ARPI 转换治疗组各有 284 例患者。其中,任何原因导致的不良事件发生率分别为 283 例(>99%)和 262 例(92%);3-4 级不良事件发生率分别为 158 例(56%)和 74 例(26%);4 级不良事件发生率分别为 21 例(7%)和 10 例(4%)(表 3)。
表3. 治疗相关的不良事件(安全性人群)
研究结论
卡博替尼联合阿替利珠单抗是一种不直接靶向雄激素受体信号的新型药物组合,或许能成为经 ARPI 治疗后发生进展且伴有软组织转移的 mCRPC 患者的有效治疗选择。
参考文献
1.Neeraj Agarwal,et al.Cabozantinib plus atezolizumab in metastatic prostate cancer (CONTACT-02): final analyses from a phase 3, open-label, randomised trial.Lancet Oncol . 2025 Jul;26(7):860-876.
