
朱瑞霞教授:当重症肌无力遇上结缔组织病,双靶点生物制剂泰它西普如何实现“双病同治”?——从真实病例进行深度解析
当“全身无力”的重症肌无力 (MG)与“全身疼痛”的结缔组织病(CTD),两种疾病挑战同时出现,是否有“一招致胜”的治疗策略?
(MG)与“全身疼痛”的结缔组织病(CTD),两种疾病挑战同时出现,是否有“一招致胜”的治疗策略?
 开辟MG与CTD联合治疗新途径
开辟MG与CTD联合治疗新途径

MG和CTD(如类风湿关节炎 、干燥综合征
、干燥综合征 [SS]和系统性红斑狼疮
[SS]和系统性红斑狼疮 [SLE])均为慢性免疫介导的自身免疫性疾病(ADs),且二者可共存1,2。活化的B细胞因子可分泌自身免疫抗体,如MG中的抗乙酰胆碱受体抗体
[SLE])均为慢性免疫介导的自身免疫性疾病(ADs),且二者可共存1,2。活化的B细胞因子可分泌自身免疫抗体,如MG中的抗乙酰胆碱受体抗体 (AChR-Ab)和SLE中的抗双链DNA抗体,表明B细胞是MG和CTD共同的关键致病机制3。在B细胞的活化、发育和存活中,B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL)起着至关重要的作用4。因此,针对B细胞活化、发育及存活的关键调控因子,采用多靶点干预策略以阻断B细胞全生命周期活化,或为MG-CTD的潜在治疗方向。
(AChR-Ab)和SLE中的抗双链DNA抗体,表明B细胞是MG和CTD共同的关键致病机制3。在B细胞的活化、发育和存活中,B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL)起着至关重要的作用4。因此,针对B细胞活化、发育及存活的关键调控因子,采用多靶点干预策略以阻断B细胞全生命周期活化,或为MG-CTD的潜在治疗方向。
在此背景下,中国医科大学附属第一医院神经内科朱瑞霞主任选择使用双靶点生物制剂泰它西普(同时靶向BLyS和APRIL)开展MG-CTD临床治疗实践,并将3例患者的治疗成果进行总结,以“Telitacicept as double-targetedtherapy for myasthenia graviscoexisting with connective tissuedisease: three case reports”为题,发表于Frontiers in Immunology(IF=5.7)期刊。结果显示,接受泰它西普治疗的3例患者均实现了显著的临床获益,提示泰它西普是治疗MG-CTD的有效双靶点疗法5。现将主要内容整理如下,以飨读者。

图1. 研究发表于Frontiers in Immunology


本报告探讨了三例MG-CTD患者的治疗效果,包括1例合并SLE和2例合并SS。三例患者均有不同程度的MG症状,包括眼睑下垂、吞咽困难 、构音障碍
、构音障碍 、肌肉无力和呼吸困难
、肌肉无力和呼吸困难 等,且伴有不同的CTD相关症状,如关节疼痛、干眼
等,且伴有不同的CTD相关症状,如关节疼痛、干眼 等。三例患者治疗前的基本信息,包括性别、年龄、疾病诊断、临床症状、相关检查结果及重症肌无力定量评分(QMG)和重症肌无力日常生活活动能力评分(MG-ADL)情况如表1所示5。
等。三例患者治疗前的基本信息,包括性别、年龄、疾病诊断、临床症状、相关检查结果及重症肌无力定量评分(QMG)和重症肌无力日常生活活动能力评分(MG-ADL)情况如表1所示5。
表1. 三例患者基本信息
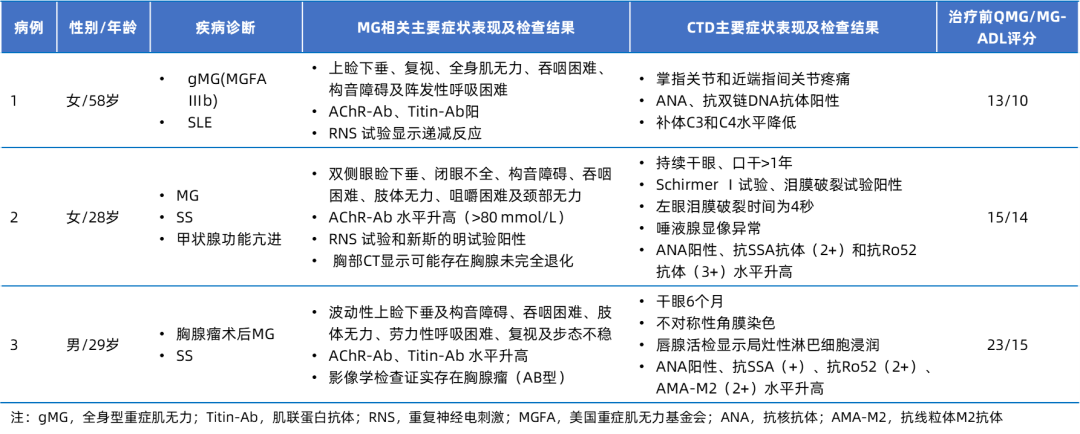
病例1接受泰它西普治疗;病例2接受泰它西普联合小剂量泼尼松(20 mg/天)治疗;病例3接受泰它西普、溴吡斯的明(240 mg/天)和泼尼松(30 mg/天)治疗5。
本报告中的三例MG-CTD患者在接受泰它西普治疗后,2-4周内MG临床症状便均有显著改善,SS/SLE症状也同样得到良好的控制,并且在减少激素剂量的同时,可在4-7周内达到最小症状表达(MSE),即MG-ADL为0或1分,并长期维持稳定(表2,图2-4)5。此外,治疗期间,所有患者免疫球蛋白(IgA、IgG和IgM)维持在正常水平,且未观察到不良事件5。
表2. 三例患者接受泰它西普后症状及激素用量变化

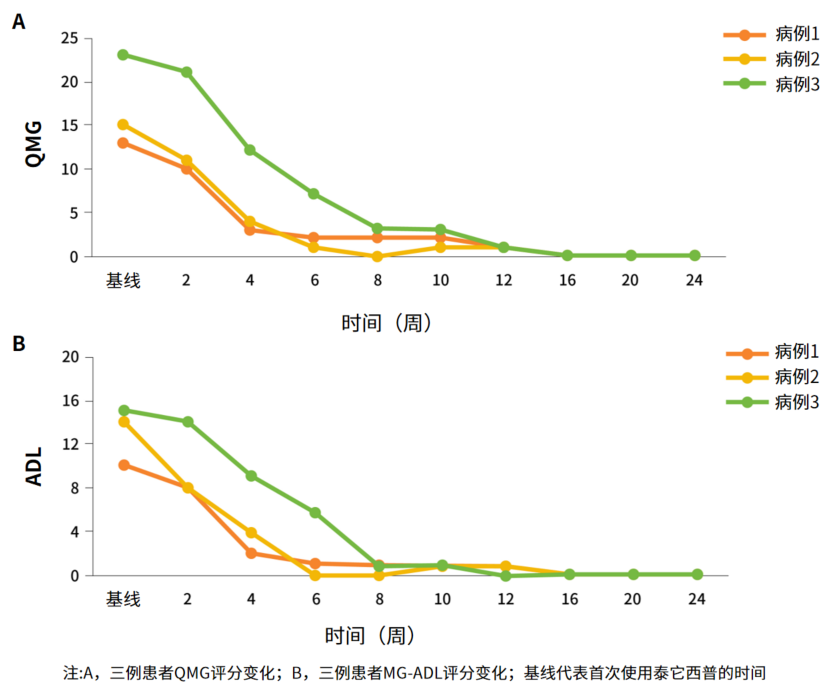
图2. 三例患者临床严重程度的变化
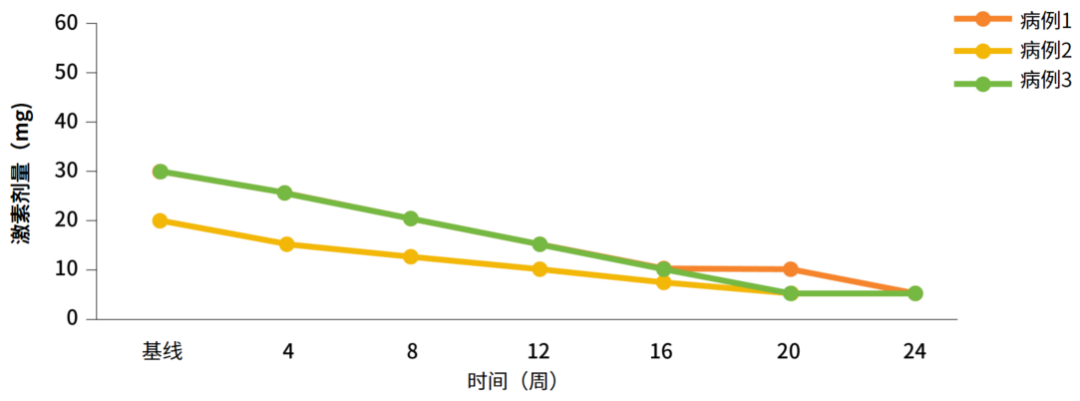
图3. 三例患者在24周内逐渐减少激素用量的过程
本病例报告结果无疑凸显了泰它西普在MG-CTD治疗中的多重优势5:
双靶机制精控:靶向抑制BLyS和APRIL,调控B细胞全生命周期,抑制自身抗体的产生,针对MG与CTD共同病理基础。
快速实现完全缓解(MSE):2-4周内MG临床症状即得到明显改善(如吞咽困难减轻、呼吸困难消失),4-7周实现完全缓解(MSE),并长期维持稳定和完全缓解。
减少激素用量:所有患者在治疗期间均实现激素减量,剂量从初始的20-30 mg/天逐步减至5 mg/天,且双病的病情维持稳定。
短期耐受良好:治疗期间,所有患者免疫球蛋白(IgA、IgG和IgM)水平正常,且未观察到不良事件。
总结
该病例报告提供了初步证据,支持泰它西普作为一种有效双靶点治疗方案,用于实现MG-CTD的“双病同治”,展现出了泰它西普在临床中的广泛应用潜力。值得注意的是,该研究也存在一些局限性,包括样本量小、缺乏对照以及随访时间相对有限。因此,未来有必要开展大规模、长期随访的随机对照试验,进一步提供有力证据以支持泰它西普在MG-CTD治疗中的潜在益处。
朱瑞霞 教授
中国医科大学附属第一医院
中国医科大学附属第一医院神经内科,教授,主任医师,硕士生导师
沈阳市拔尖人才
辽宁省神经肌肉联盟副组长
中国医师协会神经肌肉病学组委员
中国卒中学会血管性认知障碍分会委员
中国老年医学会神经医学分会委员
网络公益平台科普专家,参编人卫健康知识库
主持国家自然科学基金基金一项及省自然科学基金二项
发表英文文章多篇,累计影响因子150多分
主要擅长重症肌无力的诊断及治疗
参考文献:
1.Gilhus NE, Tzartos S, Evoli A, et al. Myasthenia gravis. Nat Rev Dis Primers. 2019 May 2;5(1):30.
2.Mao ZF, Yang LX, Mo XA, et al. Frequency of autoimmune diseases in myasthenia gravis: a systematic review. Int J Neurosci. 2011 Mar;121(3):121-9.
3.Prüss H. Autoantibodies in neurological disease. Nat Rev Immunol. 2021 Dec;21(12):798-813.
4.Mao ZF, Yang LX, Mo XA, et al. Frequency of autoimmune diseases in myasthenia gravis: a systematic review. Int J Neurosci. 2011 Mar;121(3):121-9.
5.Yang Y, Zhu Y, Zhu R. Telitacicept as double-targeted therapy for myasthenia gravis coexisting with connective tissue disease: three case reports. Front Immunol. 2025 May 27;16:1552521.

